题目内容
6.高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
(1)上述流程中可以循环使用的物质有KOH、MnO2(写化学式).
(2)若不考虑制备过程中的损失与物质循环,则1mol MnO2可制得$\frac{2}{3}$mol KMnO4;反应中二氧化锰的主要作用是还原剂(“氧化剂”、“还原剂”、“催化剂”).
(3)操作I的名称是过滤;操作Ⅱ根据KMnO4和K2CO3两物质在溶解度(填性质)上的差异,采用浓缩结晶(填操作步骤)、趁热过滤得到KMnO4粗晶体.
(4)写出母液中加入生石灰苛化时的反应总的离了方程式CO32-+CaO+H2O=CaCO3↓+2OH-.
(5)该生产中需要纯净的CO2气体.若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)CD.
A.石灰石 B.稀HCl C.稀H2SO4 D.纯碱
所需气体发生装置是A(选填序号).

分析 将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用加热浓缩、冷却结晶的方法获得KMnO4晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH;
将KMnO4晶体洗涤干燥得到纯净的KMnO4晶体;
(1)根据流程图知,KOH和MnO2都可以循环利用;
(2)根据原子守恒知,1molMnO2可制得1molK2MnO4,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,据此计算,根据流程可知,二氧化锰被氧化成K2MnO4,据此判断;
(3)分离难溶物和溶液采用过滤方法;分离易溶于水的两种溶质根据其溶解度差异性采用蒸发结晶方法.
(4)根据流程分析可知,母液中加入生石灰苛化时生成碳酸钙沉淀和氢氧化钾;
(5)石灰石、碳酸氢钠都能和稀盐酸制取二氧化碳,但制取的二氧化碳中含有HCl,稀硫酸和石灰石反应生成微溶物硫酸钙而阻止反应,稀硫酸和碳酸氢钠反应生成二氧化碳,且稀硫酸没有挥发性,根据反应物质特征和反应条件选择装置.
解答 解:将MnO2和KOH粉碎,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用加热浓缩、冷却结晶的方法获得KMnO4晶体,母液中含有K2CO3,加入CaO,发生反应K2CO3+CaO+H2O=CaCO3↓+2KOH,从而得到KOH;
将KMnO4晶体洗涤干燥得到纯净的KMnO4晶体;
(1)根据流程图知,初始反应物是KOH和MnO2,碳酸钾和石灰苛化得到KOH、锰酸钾和二氧化碳反应生成MnO2,所以KOH和MnO2都可以循环利用,
故答案为:KOH;MnO2;
(2)根据原子守恒知,1molMnO2可制得1molK2MnO4,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成$\frac{2}{3}$mol高锰酸钾,根据流程可知,二氧化锰被氧化成K2MnO4,所以二氧化锰作还原剂,
故答案为:$\frac{2}{3}$;还原剂;
(3)分离难溶物和溶液采用过滤方法,KMnO4、K2CO3易溶于水而MnO2难溶于水,所以操作I为过滤;分离易溶于水的两种溶质根据其溶解度差异性采用蒸发结晶方法,KMnO4和K2CO3都易溶于水但二者溶解度不同,所以操作Ⅱ根据KMnO4和K2CO3两物质在溶解度上的差异,采用浓缩结晶、趁热过滤得到KMnO4粗晶体,
故答案为:过滤;溶解度;浓缩结晶;
(4)根据流程分析可知,母液中加入生石灰苛化时生成碳酸钙沉淀和氢氧化钾,反应的离子方程式为CO32-+CaO+H2O=CaCO3↓+2OH-,
故答案为:CO32-+CaO+H2O=CaCO3↓+2OH-;
(5)石灰石、纯碱都能和稀盐酸制取二氧化碳,盐酸具有挥发性,所以制取的二氧化碳中含有HCl而导致二氧化碳不纯净,稀硫酸和石灰石反应生成微溶物硫酸钙而阻止反应,稀硫酸和纯碱反应生成二氧化碳,且稀硫酸没有挥发性,所以制取的二氧化碳较纯净,故选CD,该反应为固、液不加热的反应,且纯碱易溶于水,所以选择装置A,
故答案为:CD;A.
点评 本题考查物质制备实验方案设计,为高考高频点,侧重考查物质性质、基本操作、计算等知识点,明确流程图中各个环节发生的反应、操作方法是解本题关键,注意(3)中锰酸钾中的Mn元素并不完全转化到高锰酸钾还部分转化到二氧化锰中,为易错点.

| A. | 欲配制1000mL 0.1mol•L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线2cm时,再用胶头滴管加水至刻度线 | |
| B. | 将准确量取的18.4mol•L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线,即可制得100mL稀硫酸 | |
| C. | 仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 | |
| D. | 将氢氧化钠固体放在有滤纸的天平托盘上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| A. | 该反应过程中体系的混乱度减小 | |
| B. | 由于△H>0,△S>0,可知该反应的条件为高温 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 在任何条件下△H-T△S都可作为化学反应方向的判据 |
 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:①部分物质的沸点:
| 物 质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石…;装上油水分离器和冷凝管,缓慢加热回流至反应完全.
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗.
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏.
(1)第一步操作中,还缺少的试剂是浓硫酸;加入苯的目的是形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;实验过程中,酯化反应进行完全的标志是油水分离器中液体不再增加.
(2)第二步中证明“水洗”已经完成的实验方案是测定水洗液的pH至7.
(3)第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用层析法.
(4)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有5个峰.
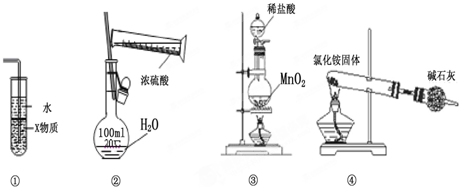
| A. | 装置中①X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| B. | 装置②可用于实验室配制一定物质的量浓度的稀硫酸 | |
| C. | 实验室用装置③制取氯气 | |
| D. | 实验室用装置④制取氨气 |
| A. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| B. | 容器中含D物质的量至少为0.45 mol | |
| C. | 容器中A的物质的量一定增加了0.30 mol | |
| D. | 容器中A、B、C、D的物质的量的比一定是4:5:4:6 |
| A. | 熔融状态的Na2O | B. | NaCl晶体 | C. | 液态H2SO4 | D. | 硫酸溶液 |
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g);经过5min后,反应达到平衡,此时转移电子6mol.