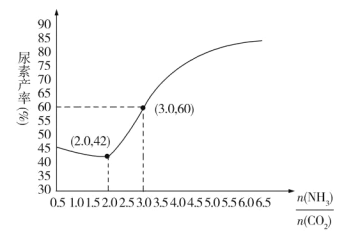
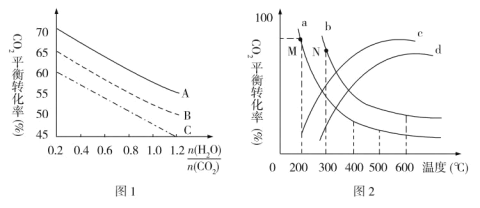
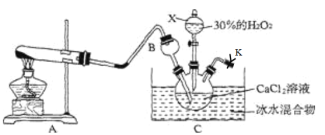
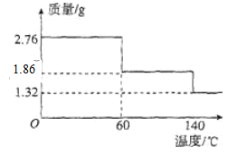
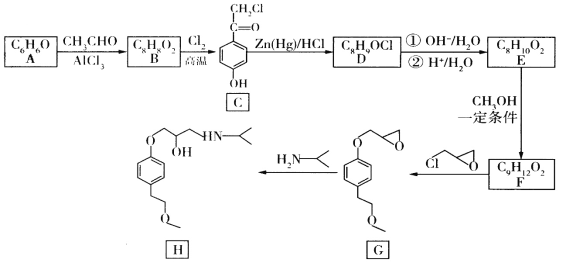
题目内容
【题目】现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:
下列说法错误的是
A.原子半径:Y>Z>XB.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态D.Y3Z4是共价化合物
【答案】C
【解析】
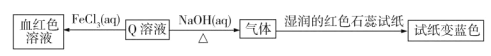
根据题给信息,Q溶液与FeCl3溶液反应生成血红色物质,可知Q溶液中含有SCN-;Q溶液与NaOH溶液共热会生成一种使湿润的红色石蕊试纸变蓝的气体,可知该气体为NH3,则Q溶液中含有NH4+。由此可推断出Q为NH4SCN。根据最外层电子数关系可知X为氢元素,Y为碳元素,Z为氮元素,R为硫元素。
A.同一周期从左至右,原子半径逐渐减小,故原子半径:C>N,H原子只有一个电子层,原子半径最小,故三者原子半径大小关系为:C>N>H,A项正确;
B.同一周期从左向右,最高价氧化物对应水化物的酸碱性规律为:碱性逐渐减弱,酸性逐渐增强。故HNO3的酸性比H2CO3强,B项正确;
C.C、H组成的烃类化合物中,常温下苯等烃类呈液态,C项错误;
D.C3N4类似于Si3N4,同属于原子晶体,是共价化合物,D项正确;
答案选C。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
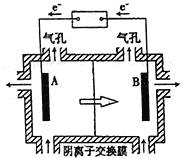
新非凡教辅冲刺100分系列答案【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
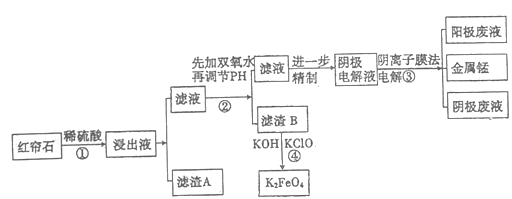
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。