题目内容
下列选项中,正确的是
- A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+
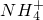 +H++
+H++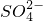 =BaSO4↓+NH3?H2O+H2O
=BaSO4↓+NH3?H2O+H2O - B.在强碱性溶液中能大量共存的离子组是:Na+、Ba2+、
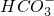 、Cl-
、Cl- - C.1.5mol NO2与足量H2O反应,转移的电子数为1.5NA(NA为阿伏加德罗常数的数值)
- D.与强酸、强碱都能反应的物质种类只有两性氧化物或两性氧氧化物
A
分析:A、依据氢氧化钡中的钡离子刚好沉淀,1mol氢氧化钡需要1mol硫酸氢铵反应分析书写;
B、弱酸的酸式盐在酸碱中都不能大量共存;
C、根据二氧化氮和水反应的化学方程式,结合氧化还原反应的化合价变化分析计算电子转移;
D、有些金属也可以和强酸强碱反应.
解答:A、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全物质的量按1:1反应,离子方程式为:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O,故A正确;
B、在强碱性溶液中HCO3-不能大量共存,发生反应HCO3-+OH-=H2O+CO32-,故B错误;
C、NO2与足量H2O反应的化学方程式为3NO2+H2O=2HNO3+NO;3molNO2反应电子转移为2mol,1.5mol NO2与足量H2O反应,转移的电子数为1NA,故C错误;
D、铝也与强酸、强碱都能反应,故D错误;
故选A.
点评:本题考查了离子方程式的书写和注意问题,主要考查酸式盐与碱反应的定量关系,离子共存判断,氧化还原反应的电子转移计算,两性物质的判断.
分析:A、依据氢氧化钡中的钡离子刚好沉淀,1mol氢氧化钡需要1mol硫酸氢铵反应分析书写;
B、弱酸的酸式盐在酸碱中都不能大量共存;
C、根据二氧化氮和水反应的化学方程式,结合氧化还原反应的化合价变化分析计算电子转移;
D、有些金属也可以和强酸强碱反应.
解答:A、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全物质的量按1:1反应,离子方程式为:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O,故A正确;
B、在强碱性溶液中HCO3-不能大量共存,发生反应HCO3-+OH-=H2O+CO32-,故B错误;
C、NO2与足量H2O反应的化学方程式为3NO2+H2O=2HNO3+NO;3molNO2反应电子转移为2mol,1.5mol NO2与足量H2O反应,转移的电子数为1NA,故C错误;
D、铝也与强酸、强碱都能反应,故D错误;
故选A.
点评:本题考查了离子方程式的书写和注意问题,主要考查酸式盐与碱反应的定量关系,离子共存判断,氧化还原反应的电子转移计算,两性物质的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).下列选项中不正确的是( )
金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).下列选项中不正确的是( )

 +H++
+H++ =BaSO4↓+NH3?H2O+H2O
=BaSO4↓+NH3?H2O+H2O 、Cl-
、Cl-