题目内容
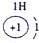
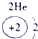
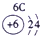
下表为元素周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)某元素原子的电子排布式为nsnnpn+1,该元素与元素①形成的分子遇到⑦与①形成的分子时的现象为
(4)元素⑨基态原子的电子排布式为
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:

请回答下列问题:
(1)表中属于d区的元素是
⑨
⑨
(填编号).(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
苯
苯
.(3)某元素原子的电子排布式为nsnnpn+1,该元素与元素①形成的分子遇到⑦与①形成的分子时的现象为
产生白烟
产生白烟
;化学方程式为NH3+HCl=NH4Cl
NH3+HCl=NH4Cl
.(4)元素⑨基态原子的电子排布式为
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
,常见化合价是+2、+3
+2、+3
.(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质.请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
Be(OH)2+2NaOH=Na2BeO2+2H2O
Be(OH)2+2NaOH=Na2BeO2+2H2O
.分析:根据元素周期表中的位置可知;①-⑩元素分别为、H、Be、C、Mg、Al、S、Cl、Ca、Fe、Cu,结合单质化合物的性质以及题目要求解答该题.
解答:解:(1)d区为过渡金属,位于ⅢB与Ⅷ之间,故元素⑨位于d区,故答案为:⑨;
(2)根据元素周期表中的位置可知;①-⑩元素分别为、H、Be、C、Mg、Al、S、Cl、Ca、Fe、Cu.①和③形成的环状分子为C6H6,名称为苯,故答案为:苯;
(3)由电子排布式nsnnpn+1可知n=2,故该原子为N,与H形成额分子为氨气,⑦与①形成的分子是氯化氢,氨气与氯化氢相遇,产生白烟,方程式为NH3+HCl=NH4Cl,
故答案为:产生白烟;NH3+HCl=NH4Cl;
(4)元素⑨为铁,铁的原子序数为26,电子排布式为1s22s22p63s23p63d64s2,铁的常见化合价为+2、+3,故答案为:1s22s22p63s23p63d64s2;+2、+3;
(5)元素⑤为铝,氢氧化铝具有两性,元素②为铍,元素⑤与元素②的氢氧化物有相似的性质,故氢氧化铍也具有两性,能与氢氧化钠反应,方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(2)根据元素周期表中的位置可知;①-⑩元素分别为、H、Be、C、Mg、Al、S、Cl、Ca、Fe、Cu.①和③形成的环状分子为C6H6,名称为苯,故答案为:苯;
(3)由电子排布式nsnnpn+1可知n=2,故该原子为N,与H形成额分子为氨气,⑦与①形成的分子是氯化氢,氨气与氯化氢相遇,产生白烟,方程式为NH3+HCl=NH4Cl,
故答案为:产生白烟;NH3+HCl=NH4Cl;
(4)元素⑨为铁,铁的原子序数为26,电子排布式为1s22s22p63s23p63d64s2,铁的常见化合价为+2、+3,故答案为:1s22s22p63s23p63d64s2;+2、+3;
(5)元素⑤为铝,氢氧化铝具有两性,元素②为铍,元素⑤与元素②的氢氧化物有相似的性质,故氢氧化铍也具有两性,能与氢氧化钠反应,方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O.
点评:元素周期表和元素周期律是每年高考中必考的,是热点题型.

练习册系列答案
相关题目









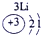
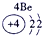
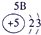
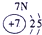
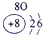
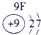
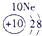
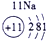





 表示的是
表示的是