题目内容
20.下列说法不正确的是( )| A. | 原电池工作时电流由负极经外电路流向正极 | |
| B. | 原电池工作时,电解质溶液中的阳离子向正极移动 | |
| C. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| D. | 电解氯化铜溶液时,铜在阴极上析出 |
分析 A、原电池工作时电流由正极经外电路流向负极;
B、原电池工作时,阳离子向正极移动;
C、电解池的阳极失电子,阴极上得电子;
D、电解氯化铜溶液时,铜离子在阴极得电子发生还原反应.
解答 解:A、原电池工作时电流由正极经外电路流向负极,故A错误;
B、原电池工作时,阳离子向正极移动,故B正确;
C、电解池的阳极失电子发生氧化反应,阴极上得电子发生还原,故C正确;
D、电解氯化铜溶液时,铜离子在阴极得电子发生还原反应生成铜,所以铜在阴极上析出,故D正确;
故选A.
点评 本题考查了原电池和电解池的原理,电极反应的分析,离子的移动是解题关键,题目较简单.

练习册系列答案
相关题目
4.下面叙述正确的是( )
| A. | 工业上用过量的碳还原二氧化硅而得到作为半导体材料的硅 | |
| B. | 二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维 | |
| C. | 水玻璃中加入少量盐酸出现白色沉淀,盐酸过量时,沉淀溶解 | |
| D. | 在Si+2NaOH+H2O═Na2SiO3+2H2↑反应中,NaOH和水均作氧化剂 |
11.下列事实不能用化学平衡移动原理解释的是( )
| A. | 合成氨工业中采用高压条件 | |
| B. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| C. | 用排饱和食盐水的方法收集Cl2 | |
| D. | 在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
8.下列各组气体中,在通常条件下能稳定共存的是( )
| A. | NH3、HCl | B. | H2S、SO2 | C. | NO、O2 | D. | N2、O2 |
5.下列各装置能够构成原电池的是( )
| A. |  | B. | 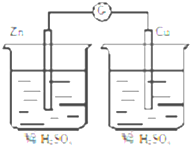 | ||
| C. |  | D. |  |
12.实验是化学学习的基础.下列实验叙述正确的是( )


| A. | 实验①试管最终会充满水 | |
| B. | 实验②试管中溶液变为血红色 | |
| C. | 可用实验③装置除去CO2气体中含有的少量HCl杂质 | |
| D. | 实验④可观察丁达尔现象 |
10.PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )
| A. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| B. | 熔沸点:X2R>X2Y | |
| C. | Z与Y形成的化合物可作为耐高温材料 | |
| D. | WY2能与碱反应,但不能与任何酸反应 |

 ;F
;F
 .
.