题目内容
15.用石墨做电极电解CuSO4溶液.通过一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )| A. | CuSO4 | B. | H2O | C. | CuO | D. | CuCO3 |
分析 用石墨电极电解CuSO4溶液,阴极铜离子放电,阳极氢氧根离子放电,然后根据析出的物质向溶液中加入它们形成的化合物即可,以此解答.
解答 解:CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu;
电解硫酸铜的方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2 Cu+O2 ↑+2H2SO4,
所以从溶液中析出的物质是氧气和铜,因为氧气和铜和稀硫酸都不反应,但和氧化铜反应,氧气和铜反应生成氧化铜,所以向溶液中加入氧化铜即可,
故选C.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析能力的考查,能正确判断溶液中离子的放电顺序从而确定析出的物质是解本题的关键,难度不大.

练习册系列答案
相关题目
5.向某密闭容器中充入1mol CO和2mol H2O(g),发生反应:CO+H2O(g) $?_{高温}^{催化剂}$CO2+H2,当反应达到平衡时,CO的体积分数为x,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
| A. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| B. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 |
6.碱金属具有特征的性质是( )
| A. | 具有银白色金属光泽 | B. | 良好的导热性 | ||
| C. | 较强的还原性 | D. | 优良的导电性 |
3.西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
 +H2O$→_{②H+}^{①OH-,△}$
+H2O$→_{②H+}^{①OH-,△}$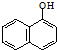 +CO2↑+CH3NH2,
+CO2↑+CH3NH2,
则下列说法正确的是( )
 +H2O$→_{②H+}^{①OH-,△}$
+H2O$→_{②H+}^{①OH-,△}$ +CO2↑+CH3NH2,
+CO2↑+CH3NH2,则下列说法正确的是( )
| A. | 西维因是一种芳香烃 | |
| B. | 西维因苯环上一溴取代产物有4种情况 | |
| C. | 可用FeCl3溶液检验西维因是否发生水解 | |
| D. | 在Ni催化下1mol西维因最多能与6molH2加成 |
10.下列有机物中属于醇的是( )
| A. | HOCHO | B. | CH3OH | C. | CH3OCH3 | D. | CH3COOH |
20.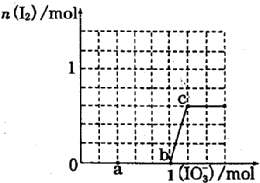 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入NaIO3溶液.加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图.下列说法正确的是( )| A. | 反应过程中的氧化产物均为Na2SO4 | |
| B. | a 点时消耗NaHSO3的物质的量为1.0mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
5.部分短周期元素的有关信息如表所示
根据表中信息,判断以下叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
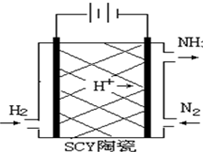 科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.
科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.