题目内容
3.19.2gSO2在标准状况下的体积为6.72L,其中含氧原子的物质的量为0.6mol,该气体在标准状况下的密度是2.9g/L.分析 根据n=$\frac{m}{M}$计算二氧化硫物质的量,再根据V=nVm计算其体积;氧原子物质的量为二氧化硫的2倍;标况下气体密度ρ=$\frac{M}{{V}_{m}}$.
解答 解:n(SO2)=19.2g÷64g.mol-1=0.3mol,
则V(SO2)=0.3mol×22.4 L.mol-1=6.72L;
n(O)=2 n(SO2)=0.6 mol;
标况下ρ(SO2)=64g.mol-1÷22.4 L.mol-1=2.9g/L,
故答案为:6.72; 0.6; 2.9g/L.
点评 本题考查物质的量有关计算,难度不大,注意理解掌握标况下气体密度计算.

练习册系列答案
相关题目
13.固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:根据上述实验,以下说法正确的是( )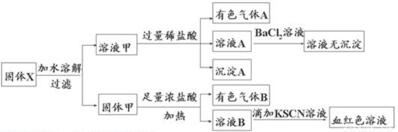

| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 无法判断溶液中是否有K2SO3 | ||
| C. | 气体A和气体B-定为混合物 | D. | 原混合物中一定有Fe2O3 |
14.下列两种溶液混合后,所得溶液中各离子浓度关系不 正确的是( )
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
11.500mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.3mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到1.12L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(Na+)=0.2 mol•L-1 | |
| B. | 电解后溶液中c(H+)=0.4mol•L-1 | |
| C. | 上述电解过程中共转移0.4 mol电子 | |
| D. | 电解后得到的Cu的物质的量为0.05mol |
18.下列说法或表述中正确的是( )
| A. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| B. | 淀粉、油脂、蛋白质、纤维素都能在人体内水解,也能在体内氧化提供能量 | |
| C. | 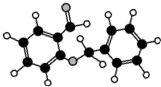 如图所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
15.在一定条件下,下列离子能大量共存的是( )
| A. | 在pH=12的溶液中:K+、Cl-、HCO3-、Na+ | |
| B. | 在[H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 使石蕊试液变红的溶液:K+、MnO4-、I-、H+ |
13.下列有关氧化还原反应的叙述中正确的是( )
| A. | 物质在反应中失去电子,该物质是氧化剂 | |
| B. | 置换反应一定属于氧化还原反应 | |
| C. | 氧化还原反应的本质是元素化合价的升降 | |
| D. | 发生反应时,电子不可以在同种元素间转移 |
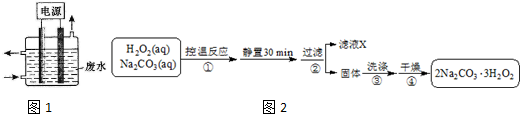
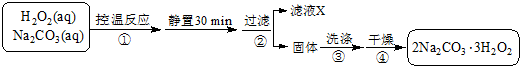
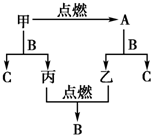 A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.