题目内容
12.根据工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0,判断下列错误的是( )| A | B | C | D |
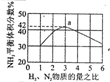 |  | 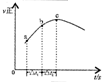 | 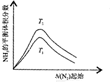 |
| 根据图中a点数据计算N2的平衡体积分数:14.5% | 表示从通入原料开始,随温度不断升高,NH3物质的量变化的曲线示意图 | 向绝热恒容器中通入N2和H2,△t1=△t2时,N2的转化率:a-b段大于b-c段 | 图中T2<T1 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
B.合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
C.随反应的进行,体系是的温度越来越高,反应速率逐渐增大,当时间相同时,转化率逐渐增大;
D.图中最高点达到平衡状态,平衡时T1平衡状态下氮气体积分数大于T2,据此根据温度对化学平衡的影响分析.
解答 解:A.依据反应特征列式计算,
N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142×$\frac{1}{4}$=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5-21=14.5,则氮气体积分数为14.5%,故A正确;
B.合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,故B正确;
C.随反应的进行,体系是的温度越来越高,反应速率逐渐增大,当时间相同时,转化率逐渐增大,故C错误;
D.图中最高点达到平衡状态,平衡时T1平衡状态下氮气体积分数大于T2,N2(g)+3H2(g)?2NH3(g)△H<0,该反应正向放热,升温平衡逆向移动,平衡状态下氮气体积分数减小,故T2<T1,故D正确.
故选C.
点评 本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,图象绘制,掌握基础是关键,题目难度较大.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氯离子的结构示意图: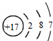 | |
| C. | 对苯二甲酸的结构简式: | |
| D. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++HCO3- |
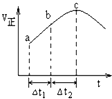 向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向某恒容密闭容器中通入N2和H2,在500℃时,使反应:N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应在c点达到平衡状态 | |
| B. | △t1=△t2时,N2的转化量:a~b段小于b~c段 | |
| C. | C点反应放出的热量达到最大 | |
| D. | 反应物浓度:a点小于b点 |
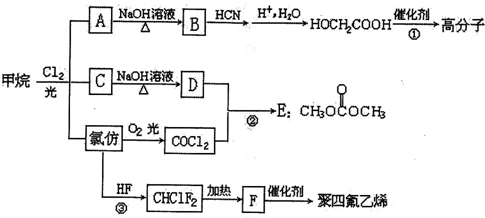
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
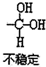
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).
| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |
 ,则M的结构式种类为( )
,则M的结构式种类为( )| A. | 16 | B. | 12 | C. | 10 | D. | 8 |

 $\stackrel{自动}{→}$
$\stackrel{自动}{→}$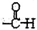
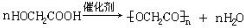 ②
②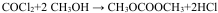
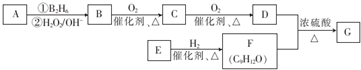
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应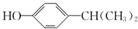
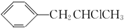 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):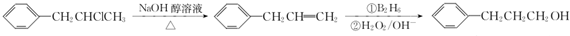 .
.