题目内容
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: .
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应: .
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化学反应的离子方程式 .
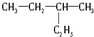
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是 (填字母).
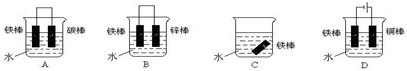
(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图1所示请回答:
①B电极对应的金属是 (写元素名称),A电极的电极反应式是
②若电镀前铁.铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差 g.
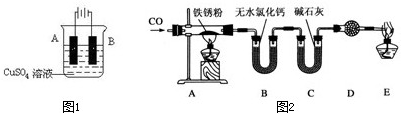
(6)某同学为了探究铁锈(Fe2O3?nH2O)的组成,将实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.
①充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为 .
②为了保证实验安全,实验开始时应先点燃 (填“A”或“E”)处的酒精灯.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3?x H2O),写出铁发生电化学腐蚀时负极的电极反应:
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化学反应的离子方程式
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是

(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图1所示请回答:

①B电极对应的金属是
②若电镀前铁.铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差
(6)某同学为了探究铁锈(Fe2O3?nH2O)的组成,将实验产生的铁锈刮下来,称取1.96g这种铁锈,按如图2所示装置进行实验.
①充分反应后,称得B装置的质量增加0.36g,C装置的质量增加1.32g,则根据实验数据,推断铁锈的化学式中n值为
②为了保证实验安全,实验开始时应先点燃
考点:金属的电化学腐蚀与防护,金属冶炼的一般原理
专题:电化学专题
分析:(1)工业上采用热还原法来制取金属铁;
(2)铁发生电化学腐蚀时,作负极失电子;
(3)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(4)一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,据此分析解答;
(5)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②根据电极反应以及两极上得失电子守恒来计算金属质量的变化;
(6)①结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值;
②实验前要先排尽装置中空气.
(2)铁发生电化学腐蚀时,作负极失电子;
(3)氧化铁可以和盐酸之间反应生成氯化铁和水,金属铁可以和氯化铁之间反应得到氯化亚铁;
(4)一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,据此分析解答;
(5)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②根据电极反应以及两极上得失电子守恒来计算金属质量的变化;
(6)①结合方程式,根据固体减少的质量与浓硫酸增重的质量列关系式计算n值;
②实验前要先排尽装置中空气.
解答:
解:(1)工业上采用一氧化碳还原氧化铁的热还原法来制取金属铁,即3CO+Fe2O3
2Fe+3CO2,
故答案为:3CO+Fe2O3
2Fe+3CO2;
(2)铁发生电化学腐蚀时,作负极失电子,其电极反应式为:Fe-2e-=Fe2+;故答案为:Fe-2e-=Fe2+;
(3)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2,其离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(4)A.该装置中铁作负极,铁易失去电子而易被腐蚀;
B.该装置中铁作正极,铁电极上易得电子而被保护;
C.铁不发生电化学腐蚀;
D.铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由难到易的顺序是D、B、C、A,
故答案为:D、B、C、A;
(5)①在铁件的表面镀铜,金属铜必须是阳极材料,金属铁为阴极,则B为铁,A为Cu失电子生成铜离子,其发生的电极反应:Cu-2e-=Cu2+,
故答案为:铁;Cu-2e-=Cu2+;
②若电镀前铁、铜两极的质量相同,电镀后两极上的电极反应:阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则阳极电极减少的质量为0.1mol×64g/mol=6.4g,阴极质量增大为6.4g,所以两个电极质量差为12.8g;
故答案为:12.8;
(3)①由题意知,固体质量减少的量为水和氧的量,无水氯化钙吸收的量为水,碱石灰吸收的是二氧化碳,反应方程式为:
Fe2O3?nH2O+3CO
2Fe+3CO2 +nH2O
160+18n 3×44
1.96g 1.32g
所以1.96g×3×44=(160+18n)g×1.32g
解得n=2,
故答案为:2;
②实验前要先排尽装置中空气,防止空气中的氧气与CO反应,所以先点燃E处的酒精灯;
故答案为:E.
| ||
故答案为:3CO+Fe2O3
| ||
(2)铁发生电化学腐蚀时,作负极失电子,其电极反应式为:Fe-2e-=Fe2+;故答案为:Fe-2e-=Fe2+;
(3)氧化铁可以和盐酸之间反应生成氯化铁和水,当铁锈除净后,金属铁可以和氯化铁之间反应得到氯化亚铁,即2FeCl3+Fe=3FeCl2,其离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe=3Fe2+;
(4)A.该装置中铁作负极,铁易失去电子而易被腐蚀;
B.该装置中铁作正极,铁电极上易得电子而被保护;
C.铁不发生电化学腐蚀;
D.铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由难到易的顺序是D、B、C、A,
故答案为:D、B、C、A;
(5)①在铁件的表面镀铜,金属铜必须是阳极材料,金属铁为阴极,则B为铁,A为Cu失电子生成铜离子,其发生的电极反应:Cu-2e-=Cu2+,
故答案为:铁;Cu-2e-=Cu2+;
②若电镀前铁、铜两极的质量相同,电镀后两极上的电极反应:阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则阳极电极减少的质量为0.1mol×64g/mol=6.4g,阴极质量增大为6.4g,所以两个电极质量差为12.8g;
故答案为:12.8;
(3)①由题意知,固体质量减少的量为水和氧的量,无水氯化钙吸收的量为水,碱石灰吸收的是二氧化碳,反应方程式为:
Fe2O3?nH2O+3CO
| ||
160+18n 3×44
1.96g 1.32g
所以1.96g×3×44=(160+18n)g×1.32g
解得n=2,
故答案为:2;
②实验前要先排尽装置中空气,防止空气中的氧气与CO反应,所以先点燃E处的酒精灯;
故答案为:E.
点评:本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识、物质结晶水含量的测定等,题目涉及的知识点较多,题目难度中等,明确原电池原理和电解池原理是解答该题的关键,注意知识的归纳和整理.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 和
和
 和
和 
 和
和