题目内容
17分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。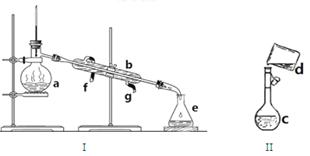
(1)写出下列仪器的名称:a. 、b. 、c.
(2)仪器a~e中,使用前必须检查是否漏水的有 (填序号)
(3)若用装置I分离水和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水由 口通入, 口流出(填f或g)
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是
②除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:
③根据计算得知,所需NaOH的质量为 g
④配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称一定质量的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.恢复到室温后将NaOH溶液沿玻璃棒注入500mL的容量瓶中(有少量溶液因操作不慎溅出瓶外) |
| D.将容量瓶盖紧,振荡、摇匀 |
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
⑤按以上操作步骤配得的NaOH溶液的物质的量浓度 (填“偏大”、“不变”或“偏小”)
⑴a. 蒸馏烧瓶 ;b. 冷凝器(管) ;c. 容量瓶;(2)c ; (3)酒精灯 , 蒸馏烧瓶支管口处 ; g; f (4)① 没有用玻璃棒引流 。② 玻璃棒、胶头滴管 ③2.0 g ④BCAFED ⑤偏小
解析试题分析:(1)根据仪器的构造特点可知,a是蒸馏烧瓶,c是容量瓶。(2)容量瓶在使用之前需要检验是否漏水,答案选c。(3)四氯化碳和酒精是互溶的,所以要分离二者的混合物,需要利用蒸馏法,因此还缺少酒精灯。由于蒸馏时温度计测量的是蒸汽的温度而不是溶液的温度,因此温度计的水银球应该放在蒸馏烧瓶的支管出口处。冷凝水流的方向是下口进水上口出水,故答案为:酒精灯 , 蒸馏烧瓶支管口处 ; g; f ;(4)①图中错误为未用玻璃棒引流②向容量瓶中转移溶液时需要用玻璃棒引流,因此根据图示可知错误的操作是未用玻璃棒引流。由于定容时还需要胶头滴管,因此缺少的仪器还有玻璃棒、胶头滴管。③由于容量瓶的规格没有450ml的,所以应该配制500ml,则需要氢氧化钠的质量是0.5L×0. 1mol/L×40g/mol=2.0g。④根据配制的原理和要求可知,正确的操作顺序是BCAFED。故答案为:① 没有用玻璃棒引流 。② 玻璃棒、胶头滴管 ③2.0 g ④BCAFED ⑤偏小
考点:实验基本操作

 阅读快车系列答案
阅读快车系列答案十七大报告指出,应加强能源资源节约和生态环境保护,增强可持续发展能力。下列行为与之不相符的是
| A.大量使用化学肥料,提高农作物的产量和质量 |
| B.将作物秸秆通过化学反应转化为乙醇用作汽车燃料 |
| C.使用资源节约型、环境友好型的生物降解塑料包装 |
| D.推广煤炭脱硫技术、减少直接燃煤,防止酸雨发生 |
15分)实验室用氢氧化钠固体配制1.0 mol/L的NaOH溶液500 mL,回答下列问题:
(1)请简要叙述该实验的主要实验步骤:
①__________________;②__________________;
③__________________;④__________________;
⑤__________________;⑥__________________。
(2)所需仪器为:容量瓶(规格为________)、托盘天平,还需要哪些实验仪器才能完成该实验,请写出:_________________________________________
(3)下列操作对所配溶液的浓度有何影响?(填写字母)
偏大的有_______________;偏小的有 ;无影响的有 。
| A.称量时使用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶中移液时,有少量液体溅出 |
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
(8分)某学生用已准确称量的2.000g烧碱固体配制一定物质的量浓度的溶液500mL。实验室提供以下仪器:
①100mL烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)。
请回答下列问题:
(1)配制时,必须使用的仪器有_________(填代号),还缺少的仪器是 (填仪器名称);
(2)配制时正确的操作顺序是(字母表示,每个操作只用一次) ;
| A.用少量水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡 |
| B.在盛有NaOH固体的烧杯中加入适量水溶解 |
| C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中 |
| D.将容量瓶盖紧,反复上下颠倒,摇匀 |
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)实验中两次用到玻璃棒,其作用分别是:先用于______ _ _,后用于___ _____ ;
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是 ;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(2)中步骤A
(5)计算:该烧碱溶液的物质的量浓度为 。
(每空2分,共12分)
用质量分数为37.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶;
(2)经计算需要量取 mL浓盐酸,在量取时宜选用下列量筒中的 。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入适量的蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。上述操作中,正确的操作顺序为 (填序号)。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度 (填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。
(5) 配制完后,应将容量瓶中的稀盐酸转移到干燥洁净的试剂瓶中存放,盖好塞子并贴上标签。
下列所用材料不属于合金的是
| A.家用的铝窗 | B.温度计用的水银 |
| C.铸造用的黄铜 | D.建筑用的钢筋 |