题目内容
6.下列事实不能用元素周期律解释的只有( )| A. | 碱性:KOH>NaOH | B. | 元素的金属性:Mg>Al | ||
| C. | 酸性:HNO3>H2CO3 | D. | 相对原子质量:Ar>K |
分析 A.金属性越强,对应碱的碱性越强;
B.同周期从左向右金属性减弱;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.Ar的相对原子质量为39.95,K的相对原子质量为39.10.
解答 解:A.金属性K>Na,对应碱的碱性KOH>NaOH,可用元素周期律解释,故A不选;
B.同周期从左向右金属性减弱,则元素的金属性:Mg>Al,可用元素周期律解释,故B不选;
C.非金属性N>C,对应最高价含氧酸的酸性HNO3>H2CO3,可用元素周期律解释,故C不选;
D.Ar的相对原子质量为39.95,K的相对原子质量为39.10,不能利用元素周期律解释,故D选.
故选D.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.根据下表中短周期元素的原子半径和主要化合价,回答表后的问题.
(1)上述元素中与元素⑧处于同一周期的有Mg、P、Cl(填元素符号)
(2)元素①在元素周期表中的位置是第二周期ⅥA族
(3)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤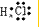 ②⑤
②⑤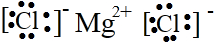 ③⑦
③⑦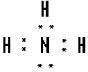
(5)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)元素①在元素周期表中的位置是第二周期ⅥA族
(3)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤
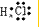 ②⑤
②⑤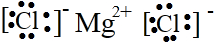 ③⑦
③⑦
(5)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
14.下列能够构成原电池的是( )
| A. |  稀硫酸 | B. |  稀盐酸 | C. |  酒精 | D. |  硫酸铜 |
11.下列关于阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的
②非金属原子不能形成阳离子
③阳离子的电子排布一定与稀有气体相同
④阳离子的价态不会大于其原子的最外层电子数
⑤阳离子都是稳定结构,不会再失去电子.
①阳离子都是由一个金属原子失去电子而形成的
②非金属原子不能形成阳离子
③阳离子的电子排布一定与稀有气体相同
④阳离子的价态不会大于其原子的最外层电子数
⑤阳离子都是稳定结构,不会再失去电子.
| A. | ①④ | B. | ②④ | C. | ①②③ | D. | ①②③④⑤ |
18.无放射性的同位素被称之为“稳定同位素”,在陆地生态系统研究中,2H、13C、15N、18O、34S等常作环境分析指示物.下列有关一些“稳定同位素”的说法错误的是( )
| A. | 34S原子核内中子数为18 | B. | 2H+的酸性比1H+的酸性更强 | ||
| C. | 16O与18O的化学性质几乎完全相同 | D. | 13C和15N原子核内的质子数相差1 |
15.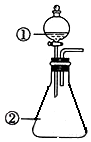 用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 液溴 | 苯 | 生成白雾 |
| A. | A | B. | B | C. | C | D. | D |
16.下列有关原电池的说法中不正确的是( )
| A. | 在内电路中,电子由正极流向负极 | |
| B. | 原电池的正、负极材料不一定都参与反应 | |
| C. | 原电池工作时,正极上发生还原反应 | |
| D. | 原电池工作时,可能会伴随着热能变化 |
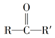 (R、R′为烃基)结构的分子
(R、R′为烃基)结构的分子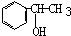 ;
;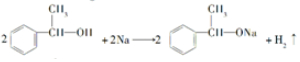 ;
;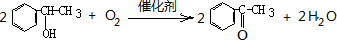 .
.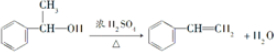 .脱水后的产物,发生聚合反应的化学方程式
.脱水后的产物,发生聚合反应的化学方程式 .
.