题目内容
临沂商城实验学校北临涑河中含有FeCl3、FeCl2、CuCl2,为临沂创建文明城市,设计水质处理方案如下:
方案一:从废液中回收铜并得到铁红(主要成分Fe2O3),全过程不引入其他金属元素.设计实验方案如图所示:
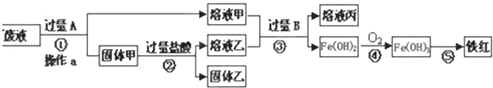
(1)工厂废液中加入过量A反应的离子方程式为 .
(2)溶液甲中的金属离子是 (写离子符号).
(3)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号).
(4)写出④的化学方程式:
方案二:制备晶体CuCl2?2H2O,已知pH=4时,Fe3+以Fe( OH)3形式完全沉淀; pH≥6.4时,Cu2+以Cu(OH)2形式完全沉淀;pH≥9.6时,Fe2+ 以Fe(OH)2形式完全沉淀.拟定实验步骤如下:
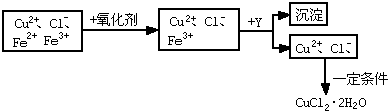
请回答下列问题:
(5)最适宜的氧化剂是 .A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(6)物质Y是 .
(7)求Fe(OH)3的Ksp= .
(8)为了防止水解,要得到CuCl2?2H2O应控制的一定条件是 .
方案一:从废液中回收铜并得到铁红(主要成分Fe2O3),全过程不引入其他金属元素.设计实验方案如图所示:

(1)工厂废液中加入过量A反应的离子方程式为
(2)溶液甲中的金属离子是
(3)步骤①②③中所发生的化学反应,其中属于置换反应的是
(4)写出④的化学方程式:
方案二:制备晶体CuCl2?2H2O,已知pH=4时,Fe3+以Fe( OH)3形式完全沉淀; pH≥6.4时,Cu2+以Cu(OH)2形式完全沉淀;pH≥9.6时,Fe2+ 以Fe(OH)2形式完全沉淀.拟定实验步骤如下:

请回答下列问题:
(5)最适宜的氧化剂是
(6)物质Y是
(7)求Fe(OH)3的Ksp=
(8)为了防止水解,要得到CuCl2?2H2O应控制的一定条件是
考点:物质分离和提纯的方法和基本操作综合应用
专题:
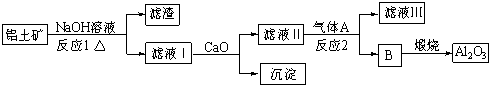
分析:方案一:根据实验目的,则含有FeCl3、FeCl2、CuCl2的废液加过量的A即铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,过滤得固体甲为铜和过量的铁,再与过量的盐酸反应后过滤得到溶液乙主要是氯化亚铁;滤液甲也是氯化亚铁,所以加过量的B即氢氧化钠反应生成氢氧化亚铁,再氧化转化成氢氧化铁,最后加热分解生成氧化铁,以此分析解答;
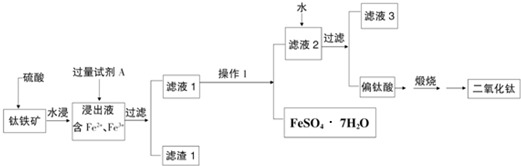
方案二:废液加氧化剂目的将二价铁氧化成三价铁,再加入Y通过调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,最后得到氯化铜溶液在氯化氢氛围中加热蒸干得到氯化铜晶体,以此解答;
(5)根据以上分析,氧化剂只用于氧化二价铁,而且不能引入新的杂质;
(6)根据以上分析,物质Y是调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,也不能引入新的杂质分析;
(7)根据Fe(OH)3的Ksp=C(Fe3+)C(OH-)3进行计算;
(8)根据加热氯化铜溶液,氯化铜水解生成易挥发的氯化氢分析.
方案二:废液加氧化剂目的将二价铁氧化成三价铁,再加入Y通过调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,最后得到氯化铜溶液在氯化氢氛围中加热蒸干得到氯化铜晶体,以此解答;
(5)根据以上分析,氧化剂只用于氧化二价铁,而且不能引入新的杂质;
(6)根据以上分析,物质Y是调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,也不能引入新的杂质分析;
(7)根据Fe(OH)3的Ksp=C(Fe3+)C(OH-)3进行计算;
(8)根据加热氯化铜溶液,氯化铜水解生成易挥发的氯化氢分析.
解答:
解:方案一:根据实验目的,则含有FeCl3、FeCl2、CuCl2的废液加过量的A即铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,过滤得固体甲为铜和过量的铁,再与过量的盐酸反应后过滤得到溶液乙主要是氯化亚铁;滤液甲也是氯化亚铁,所以加过量的B即氢氧化钠反应生成氢氧化亚铁,再氧化转化成氢氧化铁,最后加热分解生成氧化铁;
(1)根据以上分析,工厂废液中加入过量A反应的离子方程式为Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,故答案为:Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu;.
(2)根据以上分析,溶液甲是氯化亚铁,则甲中的金属离子是Fe2+,故答案为:Fe2+;
(3)根据以上分析,步骤①Fe+Cu2+=Fe2++Cu,②Fe+2H+=Fe2++H2↑,③Fe2++2OH-=Fe(OH)2↓中所发生的化学反应,其中属于置换反应的是①②,
故答案为:①②;
(4)④的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
方案二:废液加氧化剂目的将二价铁氧化成三价铁,再加入Y通过调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,最后得到氯化铜溶液在氯化氢氛围中加热蒸干得到氯化铜晶体.
(5)根据以上分析,氧化剂只用于氧化二价铁,而且不能引入新的杂质,所以最后选双氧水,故选:C;
(6)根据以上分析,物质Y是调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,也不能引入新的杂质,所以只能加入含铜的与氢离子反应的物质,故答案为:CuO或Cu(OH)2或CuCO3或碱式碳酸铜;
(7)根据Fe(OH)3的Ksp=C(Fe3+)C(OH-)3=1×10-5×(10-10)3=10-35mol4?L-4,故答案为:10-35mol4?L-4;
(8)因为加热氯化铜溶液,氯化铜水解生成易挥发的氯化氢,所以为了防止水解,要得到CuCl2?2H2O应控制的一定条件是在氯化氢氛围中加热蒸干,故答案为:在氯化氢氛围中加热蒸干.
(1)根据以上分析,工厂废液中加入过量A反应的离子方程式为Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,故答案为:Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu;.
(2)根据以上分析,溶液甲是氯化亚铁,则甲中的金属离子是Fe2+,故答案为:Fe2+;
(3)根据以上分析,步骤①Fe+Cu2+=Fe2++Cu,②Fe+2H+=Fe2++H2↑,③Fe2++2OH-=Fe(OH)2↓中所发生的化学反应,其中属于置换反应的是①②,
故答案为:①②;
(4)④的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
方案二:废液加氧化剂目的将二价铁氧化成三价铁,再加入Y通过调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,最后得到氯化铜溶液在氯化氢氛围中加热蒸干得到氯化铜晶体.
(5)根据以上分析,氧化剂只用于氧化二价铁,而且不能引入新的杂质,所以最后选双氧水,故选:C;
(6)根据以上分析,物质Y是调节PH值使三价铁沉淀二价铜不沉淀而将铁离子除去,也不能引入新的杂质,所以只能加入含铜的与氢离子反应的物质,故答案为:CuO或Cu(OH)2或CuCO3或碱式碳酸铜;
(7)根据Fe(OH)3的Ksp=C(Fe3+)C(OH-)3=1×10-5×(10-10)3=10-35mol4?L-4,故答案为:10-35mol4?L-4;
(8)因为加热氯化铜溶液,氯化铜水解生成易挥发的氯化氢,所以为了防止水解,要得到CuCl2?2H2O应控制的一定条件是在氯化氢氛围中加热蒸干,故答案为:在氯化氢氛围中加热蒸干.
点评:本题以实验的方法考查学生含铁化合物的性质知识,注重物质的分离、提纯和化学实验基本操作的知识以及根据化学方程式进行计算的知识,难度中等.

练习册系列答案
相关题目
最简便的分离方法是( )
| A、过滤 | B、蒸馏 | C、分液 | D、萃取 |
某烃的结构简式为: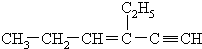 ,分子中含有四面体结构的碳原子数为a,在同一
,分子中含有四面体结构的碳原子数为a,在同一
直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c的数值分别为( )
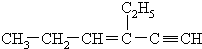 ,分子中含有四面体结构的碳原子数为a,在同一
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c的数值分别为( )
| A、4,3,5 |
| B、4,3,6 |
| C、2,5,4 |
| D、4,6,4 |
 X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.
X、Z、Q、R 4种短周期元素的原子序数依次增大,Y是一种短周期主族非金属元素.化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol?L-1甲溶液的pH=13.工业上常用电解QR饱和溶液生产甲.请填写下列空白.