题目内容
5.图是元素周期表的一部分,试用化学符号回答下列问题:| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
.(2)在这些元素中,③的气态氢化物与⑧的气态氢化物反应的现象为冒白烟,产物的晶体类型为离子晶体.
(3)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物的电子式为
 .
.(4)⑥的单质与②、④形成的某种化合物反应的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(5)在⑦、⑧两种元素中,非金属性较强的是Cl(填具体元素符号),能证明这一结论的化学方程式为Cl2+H2S=2HCl+S.
(6)科学家借助元素周期表研究合成有特定性质的新物质,如在金属与非金属交界处寻找半导体材料.
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Mg,⑦是S,⑧是Cl,⑨是Ar,
(1)上述元素中,只有Ar的最外层为8电子稳定结构;
(2)③的气态氢化物氨气与⑧的气态氢化物(HCl)反应生成氯化铵,含离子键和共价键;
(3)金属性越强,最高价氧化物的水化物碱性越强;
(4)Mg与CO2反应生成MgO和C;
(5)⑦、⑧两种元素同周期,同周期从左向右非金属性增强,可利用单质之间的置换反应说明;
(6)在金属与非金属交界处的元素,具有金属性和非金属性,可作半导体材料.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Mg,⑦是S,⑧是Cl,⑨是Ar,
(1)上述元素中,只有Ar的最外层为8电子稳定结构,单质的化学性质最不活泼,其原子结构示意图为 ,故答案为:Ar;
,故答案为:Ar; ;
;
(2)③的气态氢化物氨气与⑧的气态氢化物(HCl)反应生成固体氯化铵,观察到现象为冒白烟,含离子键和共价键,构成微粒为离子,则为离子晶体,
故答案为:冒白烟;离子晶体;
(3)金属性越强,最高价氧化物的水化物碱性越强,则Na的金属性最强,NaOH的碱性最强,NaOH的电子式为 ,
,
故答案为: ;
;
(4)Mg与CO2反应生成MgO和C,化学反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(5)⑦、⑧两种元素同周期,同周期从左向右非金属性增强,Cl的非金属性强,能证明这一结论的化学方程式为Cl2+H2S=2HCl+S,故答案为:Cl;Cl2+H2S=2HCl+S;
(6)Si为常见的半导体材料,位于金属与非金属交界处,则可知在金属与非金属交界处寻找半导体材料,故答案为:金属与非金属交界处.
点评 本题考查元素位置、结构与性质,为高频考点,涉及周期表中同周期和同主族元素的性质变化规律等,把握元素的性质、元素化合物性质是解答本题的关键,题目难度不大.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③用乙醇和63%的硫酸共热到170℃制取乙烯
④将苯和溴水混合后加入铁粉制取溴苯
⑤将敞口久置的电石与蒸馏水混合制乙炔.
| A. | 只有②③④⑤ | B. | 只有①③④⑤ | C. | ①②③④⑤ | D. | 只有①②③⑤ |
| A. | 氧的原子结构示意图: | B. | 甲烷的比例模型: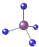 | ||
| C. | 硫化钾的电子式: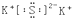 | D. | CO2的结构式:O-C-O |
| A. | 氨水呈碱性:NH3•H2O=NH4++OH- | |
| B. | 碳酸氢钠治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 久置的浓硝酸呈黄色:4HNO3=4NO2↑+O2↑+2H2O | |
| D. | 久置碳酸氢铵有刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O |
| A. | 元素分析可以鉴定有机物的实验式 | |
| B. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| C. | 红外光谱分析可以鉴定有机物中含有的官能团或化学键 | |
| D. | 核磁共振氢谱分析可以鉴定有机物中不同化学环境的氢原子及它们的数目比 |
| A. | 3mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.1mol•L-1 |
| A. | NaCl | B. | NaBr、NaI、NaCl | C. | NaBr、NaI | D. | NaCl、I2 |
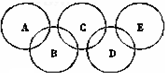 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
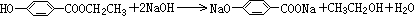 ;
; ;
; .
.