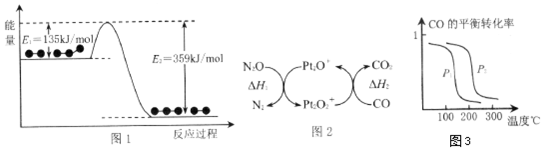
题目内容
10.将6.5g锌投入200mL某浓度的稀盐酸中,锌和稀盐酸恰好完全反应.求:(1)6.5g锌的物质的量为0.1mol;
(2)所用稀盐酸中HCl的物质的量浓度为1mol/L;
(3)反应中生成的H2在标准状况下的体积为2.24L;
(4)向反应后的溶液中加水至500mL,求此时氯化锌的物质的量浓度为0.2mol/L.
分析 (1)据n=$\frac{m}{M}$进行计算;
(2)根据方程式计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度;
(3)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(4)加水稀释物质的量不变,利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)n=$\frac{m}{M}$=$\frac{6.5}{65}$=0.1mol,故答案为:0.1mol;
(2)令HCl的物质的量为nmol,则:
Zn+2HCl=ZnCl2+H2↑
65g 2mol
6.5g nmol
所以$\frac{65g}{6.5g}=\frac{2mol}{nmol}$解得n=0.2
故该盐酸的物质的量浓度为:$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:1mol/L;
(3)由化学方程式Zn+2HCl=ZnCl2+H2↑可知:n(H2)=n(Zn)=0.1 mol,所以氢气的体积为:0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
(4)n(ZnCl2)=n(Zn)=0.1 mol,所以c(ZnCl2)=$\frac{0.1mol}{0.5L}$=0.2mol/L,故答案为:0.2mol/L.
点评 本题考查根据方程式的计算、常用化学计量的有关计算,比较基础,注意基础知识的掌握与根据方程式计算的格式.

练习册系列答案
相关题目
1.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”. S2O32-和Cl2反应的产物之一为SO42-.下列说法中,不正确的是( )
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
18.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4, 振荡,静置 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
5.可用分液漏斗分离的一组混合物是( )
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
15.五种主族元素在周期表中的位置如表所示.L的单质在常温常压下呈液态,且保存时需要用水液封.下列推断正确的是( )
| X | Y | Z | T | |
| L |
| A. | 原子半径:X<Y<Z<T<L | |
| B. | 气态氢化物的还原性:L>Z>T | |
| C. | 含x的两种盐溶液混合可能生成沉淀 | |
| D. | Y的含氧酸的酸性小于T的含氧酸 |
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |
20.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 12g石墨烯( 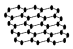 )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
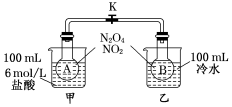 为测定温度对平衡的影响,设计了如下试验.
为测定温度对平衡的影响,设计了如下试验.