题目内容
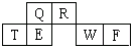 短周期元素Q、R、T、E、W、F在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.
短周期元素Q、R、T、E、W、F在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素.请回答下列问题:
(1)Q位于周期表第
(2)T的离子结构示意图为
(3)R元素的氢化物(四核分子)的电子式为
(4)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(5)0.5mol Q单质与0.5mol 水蒸气恰好反应生成0.5mol H2时,需要吸收65.75kJ的热量,写出该反应的热化学方程式
(6)T的单质与W的最高价氧化物的水化物浓溶液共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味.你猜想该气体是
(7)E与F形成的化合物和足量水反应生成一种弱酸和一种强酸,该反应化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素,则T为Al,由元素的相对位置可知,Q为碳、E为Si、R为氮、W为硫、F为Cl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8;同周期自左而右非金属性增强;
(3)R元素的氢化物(四核分子)为NH3,分子中N原子与H原子之间形成1对共用电子对;
(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水;
(5)发生反应:C+H2O=CO+H2,计算1mol碳反应吸收的热量,标明物质的聚集状态与反应热,书写热化学方程式;
(6)Al与浓硫酸共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味,该气体应为SO2,将生成的气体通入品红溶液,若溶液褪色,证明为二氧化硫;
(7)E与F形成的化合物为SiCl4,足量水反应生成一种弱酸和一种强酸,应生成硅酸与HCl.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8;同周期自左而右非金属性增强;
(3)R元素的氢化物(四核分子)为NH3,分子中N原子与H原子之间形成1对共用电子对;
(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水;
(5)发生反应:C+H2O=CO+H2,计算1mol碳反应吸收的热量,标明物质的聚集状态与反应热,书写热化学方程式;
(6)Al与浓硫酸共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味,该气体应为SO2,将生成的气体通入品红溶液,若溶液褪色,证明为二氧化硫;
(7)E与F形成的化合物为SiCl4,足量水反应生成一种弱酸和一种强酸,应生成硅酸与HCl.
解答:
解:T所处的周期序数与主族序数相等,T元素为地壳中含量最多的金属元素,则T为Al,由元素的相对位置可知,Q为碳、E为Si、R为氮、W为硫、F为Cl.
(1)Q为碳元素,原子核外有2个电子层,最外层电子数为4,处于第二周期ⅣA族,故答案为:二、ⅣA;
(2)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为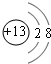 ;同周期自左而右非金属性增强,故非金属性C<N,故答案为:
;同周期自左而右非金属性增强,故非金属性C<N,故答案为: ;<;
;<;
(3)R元素的氢化物(四核分子)为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,反应方程式为:S+2H2SO4(浓)
3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)
3SO2↑+2H2O;
(5)发生反应:C+H2O=CO+H2,1mol碳反应吸收的热量=65.75kJ×2=131.5kJ,该反应热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(6)Al与浓硫酸共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味,该气体应为SO2,将生成的气体通入品红溶液,若溶液褪色,证明该气体为二氧化硫,
故答案为:SO2;将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫;
(7)E与F形成的化合物为SiCl4,足量水反应生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应方程式为:SiCl4+3H2O=H2SiO3+4HCl,故答案为:SiCl4+3H2O=H2SiO3+4HCl.
(1)Q为碳元素,原子核外有2个电子层,最外层电子数为4,处于第二周期ⅣA族,故答案为:二、ⅣA;
(2)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为
 ;同周期自左而右非金属性增强,故非金属性C<N,故答案为:
;同周期自左而右非金属性增强,故非金属性C<N,故答案为: ;<;
;<;(3)R元素的氢化物(四核分子)为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为:
 ,故答案为:
,故答案为: ;
;(4)硫与浓硫酸在加热条件下反应生成二氧化硫与水,反应方程式为:S+2H2SO4(浓)
| ||
故答案为:S+2H2SO4(浓)
| ||
(5)发生反应:C+H2O=CO+H2,1mol碳反应吸收的热量=65.75kJ×2=131.5kJ,该反应热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol;
(6)Al与浓硫酸共热,一段时间后发现固态表面有大量无色气泡冒出,同时还异常地嗅到了一股刺激性气味,该气体应为SO2,将生成的气体通入品红溶液,若溶液褪色,证明该气体为二氧化硫,
故答案为:SO2;将生成的气体通入品红溶液,若溶液褪色,则证明该气体为二氧化硫;
(7)E与F形成的化合物为SiCl4,足量水反应生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应方程式为:SiCl4+3H2O=H2SiO3+4HCl,故答案为:SiCl4+3H2O=H2SiO3+4HCl.
点评:本题考查结构性质位置关系应用,涉及核外电子排布、元素周期律、热化学方程式、元素化合物性质等,侧重考查学生对基础知识的迁移应用,难度中等.

练习册系列答案
相关题目
下列有机物的命名正确的是( )
| A、Br-CH2-CH2-Br二溴乙烷: |
B、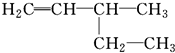 3-乙基-1-丁烯: 3-乙基-1-丁烯: |
C、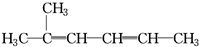 2-甲基-2,4-己二烯: 2-甲基-2,4-己二烯: |
D、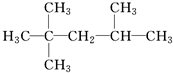 2,2,3-三甲基戊烷: 2,2,3-三甲基戊烷: |
下列物质中,既能与盐酸反应,又能与NaOH溶液反应的是( )
A、 |
B、 |
| C、H2NCH2COONa |
| D、Na2CO3 |
下列有关反应类型说法中正确的是( )
A、由乙二醇制取高分子 是通过加聚反应完成的 是通过加聚反应完成的 |
| B、乙醇在浓硫酸作催化剂,并且加热的条件下一定发生消去反应 |
| C、卤代烃一般来说在NaOH的水溶液中能发生取代反应,而在NaOH的醇溶液中不一定能发生消去反应 |
| D、酯类物质在一定条件下水解一定得到相应的羧酸和醇 |
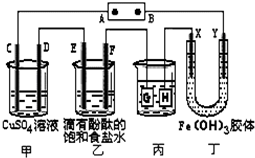 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.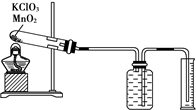 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下: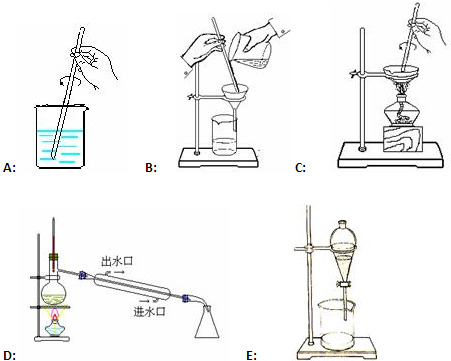
 (3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
(3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是