题目内容
2.下列热化学方程式表达正确的是(△H的绝对值均正确)( )| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol (反应热) | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=+57.3kJ/mol(中和热) | |
| D. | 2NO2=O2+2NO△H=+116.2kJ/mol (反应热) |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、热化学方程式是标注物质聚集状态,反应放出的热量;
C、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
D、热化学方程式是标注物质聚集状态,反应放出的热量.
解答 解:A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成的氧化物水是气体,不是稳定氧化物,故A错误;
B、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),符合热化学方程式的书写,故B正确;
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol(中和热),故C错误;
D、2NO2=O2+2NO△H=+116.2kJ/mol(反应热),未标注物质聚集状态,故D错误.
故选B.
点评 本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
12.下列物质中含有非极性共价键的离子化合物是( )
| A. | Cl2 | B. | Na2O2 | C. | H2O2 | D. | MgCl2 |
13.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后驾车.反应的方程式为:2CrO3+3CH3CH2OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O,此反应的氧化剂是( )
| A. | H2SO4 | B. | CrO3 | C. | Cr2(SO4)3 | D. | CH3CH2OH |
10.可用来鉴别己烯、四氯化碳、甲苯的方法是( )
| A. | 酸性高锰酸钾 | B. | 溴水 | C. | 液溴 | D. | NaOH |
17.下列表示物质结构的化学用语或模型正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 丙烯分子的结构简式为 CH3CHCH2 |
7.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
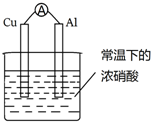

| A. | Cu是原电池的负极 | |
| B. | 电流由Cu电极流出 | |
| C. | 电子由Al沿导线流向Cu | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
14.铅蓄电池反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列说法中正确的是( )
| A. | 放电时,蓄电池内电路中H+向负极移动 | |
| B. | 放电时,每通过lmol电子,蓄电池就要消耗2molH2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-→Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
11.用氯化铝制取纯净的硝酸铝的最佳方法是( )
| A. | 用氯化铝和纯硝酸反应 | |
| B. | 氯化铝与氢氧化钠反应,过滤得沉淀,再加稀HNO3 | |
| C. | 用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | AlCl3溶液和Ba(NO3)2溶液反应 |
12.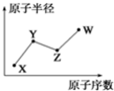 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | X、Y、Z三种元素形成的化合物均为强酸 | |
| C. | Y的氢化物可用于检验W的单质是否泄漏 | |
| D. | 如W的单质泄漏,可以用湿毛巾蘸Y的氢化物的水溶液逃生 |