题目内容
下列反应的离子方程式正确的是( )
①向氯化铝溶液中加入过量氨水 Al3++4NH3?H2O═[Al(OH)4]-+4NH4+
②铁屑溶于足量稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O
④0.1molFeBr2中通入0.1mol Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
⑤硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH-
⑥向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-.
①向氯化铝溶液中加入过量氨水 Al3++4NH3?H2O═[Al(OH)4]-+4NH4+
②铁屑溶于足量稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O
④0.1molFeBr2中通入0.1mol Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-
⑤硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH-
⑥向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-.
| A、①②③ | B、②③⑥ |
| C、③④⑥ | D、④⑤⑥ |
考点:离子方程式的书写
专题:离子反应专题
分析:①二者反应生成氢氧化铝,氢氧化铝不溶于氨水;
②铁屑溶于足量稀硝酸生成铁离子和NO;
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全,二者以1:1反应,生成硫酸钡、氢氧化钠和水;
④0.1molFeBr2中通入0.1mol Cl2,溶液中有0.1mol亚铁离子、0.2mol溴离子,亚铁离子被氧化需要0.05mol氯气,剩余0.05mol氯气氧化0.1mol溴离子;
⑤硫化钠中硫离子水解生成硫氢根离子和氢氧根离子,第二步硫氢根离子水解生成硫化氢和氢氧根离子;
⑥向苯酚钠溶液中通入少量CO2,二者反应生成碳酸氢钠和苯酚.
②铁屑溶于足量稀硝酸生成铁离子和NO;
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全,二者以1:1反应,生成硫酸钡、氢氧化钠和水;
④0.1molFeBr2中通入0.1mol Cl2,溶液中有0.1mol亚铁离子、0.2mol溴离子,亚铁离子被氧化需要0.05mol氯气,剩余0.05mol氯气氧化0.1mol溴离子;
⑤硫化钠中硫离子水解生成硫氢根离子和氢氧根离子,第二步硫氢根离子水解生成硫化氢和氢氧根离子;
⑥向苯酚钠溶液中通入少量CO2,二者反应生成碳酸氢钠和苯酚.
解答:
解:①向氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝,氢氧化铝不溶于氨水,离子方程式为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故错误;
②铁屑溶于足量稀硝酸生成铁离子和NO,离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故正确;
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全,二者以1:1反应,生成硫酸钡、氢氧化钠和水,离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故正确;
④0.1molFeBr2中通入0.1mol Cl2,溶液中有0.1mol亚铁离子、0.2mol溴离子,亚铁离子被氧化需要0.05mol氯气,剩余0.05mol氯气氧化0.1mol溴离子,离子方程式为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故错误;
⑤硫离子有两步水解,以第一步水解为主,水解离子方程式为:S2-+H2O?HS-+OH-,故错误;
⑥向苯酚钠溶液中通入少量CO2,二者反应生成碳酸氢钠和苯酚,离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故正确;
故选B.
②铁屑溶于足量稀硝酸生成铁离子和NO,离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故正确;
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全,二者以1:1反应,生成硫酸钡、氢氧化钠和水,离子方程式为:Ba2++OH-+H++SO42-═BaSO4↓+H2O,故正确;
④0.1molFeBr2中通入0.1mol Cl2,溶液中有0.1mol亚铁离子、0.2mol溴离子,亚铁离子被氧化需要0.05mol氯气,剩余0.05mol氯气氧化0.1mol溴离子,离子方程式为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故错误;
⑤硫离子有两步水解,以第一步水解为主,水解离子方程式为:S2-+H2O?HS-+OH-,故错误;
⑥向苯酚钠溶液中通入少量CO2,二者反应生成碳酸氢钠和苯酚,离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故正确;
故选B.
点评:本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等,注意苯酚钠和二氧化碳反应时,无论二氧化碳是否变化都生成碳酸氢钠,为易错点.

练习册系列答案
相关题目
下列叙述中不正确的是( )
| A、在水溶液里或熔融状态下能够导电的化合物叫做电解质 |
| B、胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9 m-10-7m之间 |
| C、交叉分类法和树状分类法是化学上常用的两种分类方法 |
| D、溶液是电中性的,胶体是带电的 |
下列离子方程式正确的是( )
| A、碳酸钙与醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、澄清石灰水中加入盐酸:Ca(OH)2+2H+=Ca2++2H2O |
| C、铁片加入稀硫酸中:Fe+2H+=Fe3++H2↑ |
| D、小苏打溶液和醋酸混合:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O |
2006年11月23日中科院网报道,纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和作为药物载体用于疾病的治疗.其制备过程如下:

下列叙述不合理的是( )

下列叙述不合理的是( )
| A、Fe3O4可以表示为FeO?Fe2O3,属于混合物 |
B、在反应②中FeCl3?6H2O被环丙胺 还原为FeOOH 还原为FeOOH |
| C、纳米四氧化三铁分散在适当分散剂中,形成的分散系可能有丁达尔现象 |
| D、反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2 |
常温下,发生下列几种反应:①16H++10Z-?+2XO
═2X2++5Z2+8H2O ②2A2++B2═2A3++2B- ③2B-?+Z2═B2+2Z-?根据上述反应,判断下列结论错误的是( )
- 4 |
A、X2+是XO
| ||
B、氧化性强弱的顺序为:XO
| ||
| C、Z2在①③反应中均为还原剂 | ||
| D、溶液中可发生:Z2+2A2+═2A3++2Z? |
在不同情况下测得A(g)+3B(g)?2C(g)+2D(g)的下列反应速率,其中反应速率最大的是( )
| A、v(D)=0.4mol?L-1?s-1 |
| B、v(C)=0.5mol?L-1?s-1 |
| C、v(B)=0.6mol?L-1?s-1 |
| D、v(A)=0.15mol?L-1?s-1 |
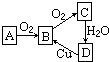 在通常情况下,A是单质,A、B、C、D均含有同一种元素,它们的相互转化关系如图所示.
在通常情况下,A是单质,A、B、C、D均含有同一种元素,它们的相互转化关系如图所示.