题目内容
18.下列各组顺序的排列不正确的是( )| A. | 酸性强弱:H4SiO4<H2CO3<HNO3 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |
分析 A.非金属性越强,对应最高价氧化物的水化物酸性越强;
B.非金属性越强,对应气态氢化物越稳定;
C.同周期,原子序数大的金属性弱;
D.一般来说,熔点为原子晶体>离子晶体>分子晶体.
解答 解:A.非金属性Si<C<N,对应最高价氧化物的水化物酸性为H4SiO4<H2CO3<HNO3,故A正确;
B.非金属性Cl>S>P,对应气态氢化物的稳定性为HCl>H2S>PH3,故B正确;
C.同周期,原子序数大的金属性弱,则金属性为Na>Mg>Al,故C错误;
D.一般来说,熔点为原子晶体>离子晶体>分子晶体,则熔点为金刚石(原子晶体)>食盐(离子晶体)>干冰(分子晶体),故D正确;
故选C.
点评 本题考查元素周期律及元素周期表的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
8.在同温同压下,使4体积的H2和O2混合气体充分反应,生成液态水,最后剩余1体积气体,则混合体中的H2和O2的体积比可能是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
9.X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )

| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若W是氢氧化钠,则X与Z可反应生成Y | |
| C. | 若W是强氧化性的单质,则X可能是金属铝 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差14 |
3.苯分子中的碳碳键不是单双键交替的,不能作出这种判断的证据是( )
| A. | 苯的邻位二元取代物只有一种 | B. | 苯环中碳碳键均相同 | ||
| C. | 苯的一元取代物无同分异构体 | D. | 苯不使酸性KMnO4溶液褪色 |
10.实验室制取少量N2常利用的反应是:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
| A. | NaNO2是氧化剂 | B. | 生成1molN2时转移的电子为3mol | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
7.室温下,对于0.1mol?L-1的氨水,下列有关说法正确的是( )
| A. | 氨水能导电,说明NH3是电解质 | |
| B. | 加水稀释,溶液中的c(OH-)增大 | |
| C. | 加入稀硫酸至溶液的pH=7,c(NH4+)=c(SO42-) | |
| D. | 向含有酚酞的氨水中加入少量NH4Cl晶体,溶液颜色变浅 |
8.某高聚物可表示为图所示,则下列叙述不正确的是( )
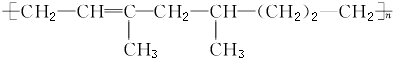
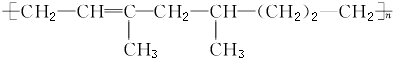
| A. | 该高聚物是通过加聚反应生成的 | |
| B. | 合成该高聚物的单体有三种 | |
| C. | 1 mol该物质能与1 mol H2加成,生成不含碳碳双键的物质 | |
| D. | 该高聚物能被酸性KMnO4溶液氧化 |