题目内容
17.下列有关说法正确的是( )| A. | 在轮船船体四周镶嵌锌块可以减少船体的腐蚀 | |
| B. | 通常情况下水分子较稳定是因为水分子间存在氢键 | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)(△H>0),其他条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 | |
| D. | 相同温度下pH均为5的氯化铵溶液和醋酸溶液中水的电离程度相同 |
分析 A.在轮船船体四周镶嵌锌块,铁和锌在海水中形成原电池,形成原电池时,活泼性强的被腐蚀;
B.氢键是分子间作用力与分子的稳定性无关,水分子稳定是因为水中的共价键强;
C.该反应的正反应为吸热反应,则升高温度平衡向正方向移动,正逆反应速率增大;
D.醋酸抑制了水的电离,氯化铵中铵离水解促进了水的电离;
解答 解:A.形成原电池时,活泼性强的被腐蚀,则在海轮外壳上附着一些锌块,形成原电池时Zn被腐蚀,铁被保护,所以可以减缓海轮外壳的腐蚀,故A正确;
B.氢键只影响物质的物理性质,H2O是一种非常稳定的化合物,是因为H-O键的稳定性强,故B错误;
C.C(s)+H2O(g)═CO(g)+H2(g)(△H>0),其他条件不变时,升高温度,正反应速率增大、逆反应速率增大,平衡正向移动,故C错误;
D.盐酸抑制了水的电离,而氯化铵溶液中铵离子水解,促进了水的电离,所以两溶液中水的电离程度不相同,故D错误;
故选A.
点评 本题考查原电池原理、分子稳定性判断、化学平衡的影响因素、弱电解质电离平衡和盐类水解平衡影响因素分析,为高考常见题型,掌握基础是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法正确的是( )
| A. | 加大煤燃烧时与空气的接触面积,是为了获得更多的能量 | |
| B. | 钢铁易生锈被腐蚀,而铝、银等金属不容易被腐蚀,是因为铁的活泼性强 | |
| C. | 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能 | |
| D. | 在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率 |
8.图示意铝在氧气中燃烧的实验,铝条点燃后,为维持燃烧继续,正确的操作是( )
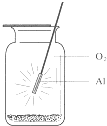

| A. | 铝条应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铝条插入集气瓶接近瓶底位置 | |
| C. | 将铝条从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铝条应不断上下移动 |
12.BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
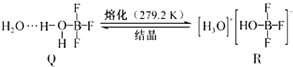
晶体Q中各种微粒间的作用力不涉及( )

晶体Q中各种微粒间的作用力不涉及( )
| A. | 离子键 | B. | 共价键 | C. | 配位键 | D. | 氢键 |
9.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解在1L 水中 | |
| B. | 将22.4LHCl气体溶于水配成1L溶液 | |
| C. | 将1 L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
9.下列物质一定表示一种纯净物的是( )
| A. | CHCl3 | B. | C4H10 | C. |  | D. | C5H12 |
 有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为
有机物的结构可用“键线式”简化表示,如:CH3一CH=CH-CH3可表示为 ,有一种有机物X的键线式如图所示.
,有一种有机物X的键线式如图所示. ;
; C6H14
C6H14 C5H10
C5H10 C7H12
C7H12 C8H10.
C8H10.