题目内容
14.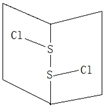 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )| A. | 与S2Br2结构相似,熔沸点S2Br2>S2Cl2 | |
| B. | 分子中既含有极性键又含有非极性键 | |
| C. | 与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| D. | 为非极性分子 |
分析 A、分子晶体中,分子量越大则熔沸点越高;
B、同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键;
C、遇水易水解,并产生酸性悬浊液,说明有沉淀生成、有酸性物质生成;
D、分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,是不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A、S2Br2与S2Cl2均属于分子晶体,分子晶体中,分子量越大则熔沸点越高,所以熔沸点:S2Br2>S2Cl2,故A正确;
B、Cl-S-S-Cl 中硫原子和硫原子之间存在非极性键,硫原子和氯原子之间存在极性键,故B正确;
C、Cl-S-S-Cl 遇水易水解,并产生酸性悬浊液,说明有不溶于水的物质生成,且有溶于水呈酸性的物质生成,根据反应前后元素守恒知,生成不溶于水的物质是S单质,同时生成二氧化硫和氯化氢,所以水解方程式为2S2Cl2+2H2O→SO2↑+3S↓+4HCl,故C正确;
D、该分子中,电荷的分布是不均匀的,不对称的,所以是极性分子,故D错误;
故选D.
点评 本题以元素化合物知识为载体考查了分子极性的判断、水解反应、熔沸点大小的判断等知识点,难度较大,易错选项是A,注意极性分子的判断方法、物质熔沸点与相对分子质量的关系等问题.

练习册系列答案
相关题目
4.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 变质的油脂有特殊难闻气味,是因为油脂发生了氧化反应 | |
| D. | 制作快餐盒的聚苯乙烯塑料是易降解塑料 |
5.如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )


| A. | 装置X能实现燃料电池的燃料和氧化剂再生 | |
| B. | 装置Y中负极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该系统中只存在3种形式的能量转化 | |
| D. | 装置X、Y形成的子系统能实现物质零排放,并能实现化学能与电能间的完全转化 |
2.一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24L(标准状况下),则下列情况不可能的是( )
| A. | 加入Cu的质量为6.4g | B. | 加入Cu的质量大于6.4g | ||
| C. | 加入浓H2SO4中含溶质为0.2mol | D. | 加入浓H2SO4中含溶质大于0.2mol |
9.下列电子式正确的是( )
| A. | 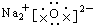 | B. | 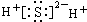 | ||
| C. | 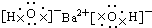 | D. |  |
19.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题.
(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

(1)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl═SiH4+4NH3+2MgCl2.
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能 (kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(3)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为1:3.

3.下列说法正确的是( )
| A. | 同周期ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第3周期元素的离子半径从左到右逐渐减小 |
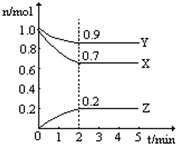 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: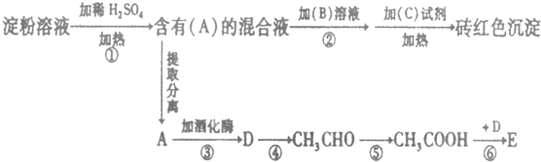
 .
.