题目内容
15.下列有关酸、碱、盐的说法中,错误的是( )| A. | 酸根中可能含有氧元素 | B. | 正盐中一定不含氢元素 | ||
| C. | 碱中一定含有氢元素和氧元素 | D. | 酸式盐中含有氢元素 |
分析 酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物,酸式盐是多元酸和碱部分反应得到的盐,据此进行分析判断即可.
解答 解:A、酸是电离时电离出的阳离子全部是氢离子的化合物,酸中可能有氧,例如硫酸,故A正确;
B、盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物,盐中不一定含有氢元素,如NaCl,故B错误;
C、碱是电离时电离出的阴离子全部是氢氧根离子的化合物,故碱中一定含的氢元素,故C正确;
D、酸是电离时电离出的阳离子全部是氢离子的化合物,酸式盐是多元酸和碱部分反应生成,故酸式盐中一定含氢元素,故D正确;
故选B.
点评 本题难度不大,掌握酸、碱、盐的概念、特征并能灵活运用即可正确解答本题.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
5.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{氯气}$ SiCl4 $→_{高温}^{氢气}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$ MgCl2(aq)$\stackrel{电解}{→}$ Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$ FeCl3(aq)$\stackrel{蒸发}{→}$ 无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{加热}^{蔗糖}$ Ag |
6.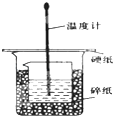 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g•℃),则写出该反应的热化学方程式(离子方程式)H+(aq)+OH-(aq)=H2O(l)△H=-56.0kJ/mol (△H值保留到小数点后1位).
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
3.日常所用的干电池,其电极分别为碳棒(上面有帽)和锌(皮),以糊状NH4Cl和ZnCl2作为电解质溶液(其中加入MnO2吸收H2),电极反应可简化为Zn-2e-═Zn2+,2NH4++2e-═2NH3↑+H2↑(NH3与Zn2+结合),根据上面叙述判断下列说法正确的是( )
| A. | Zn为正极,碳为负极 | |
| B. | 负极反应为2NH4++2e-═2NH3↑+H2↑ | |
| C. | 工作时电子由碳极经外电路流向锌极 | |
| D. | 长时间连续使用时,内装的糊状物可能流出腐蚀电器 |
10.下列物质中的杂质(括号内为杂质)不能用加热法直接除去的是( )
| A. | Fe粉(硫粉) | B. | Na2CO3粉末(NaHCO3) | ||
| C. | NaCl(碘) | D. | KMnO4(MnO2) |
7.下列说法正确的是( )
| A. | CuSO4 •5H2O、磁性氧化物都是纯净物 | |
| B. | 一种物质不是电解质就是非电解质 | |
| C. | 稀硫酸、NaCl溶液是实验室常见的电解质 | |
| D. | 二氧化硫可广泛用于食品的增白 |
5.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是①②③.
| N2(g) | + | 3H2(g) | ? | 2NH3 | |
| ① | 1mol | 3mol | 0mol | ||
| ② | 0mol | 0mol | 2mol | ||
| ③ | 0.5mol | 1.5mol | 1mol | ||
| ④ | 1mol | 3mol | 2mol |