题目内容
(12分)某校化学小组学生进行如下实验。
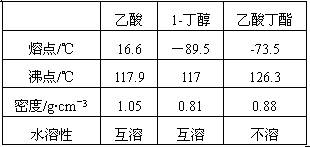
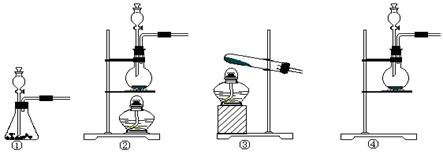
(1)使用铜和稀硫酸制备硫酸铜晶体。
步骤如下:

步骤①观察到的现象是 。步骤③的主要操作包括: 。
(2)硫酸铜溶解度的测定。
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是 。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 。
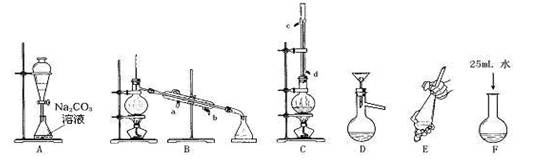
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是 。

若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是
。
(1)使用铜和稀硫酸制备硫酸铜晶体。
步骤如下:

步骤①观察到的现象是 。步骤③的主要操作包括: 。
(2)硫酸铜溶解度的测定。
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是 。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 。
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是 。

若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是
。
(12分)(1)红色固体变黑; 加热浓缩,冷却结晶,过滤(各2分,共4分)
(2)Cu2++2e-="=Cu " 20 g(各2分,共4分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解。(各2分,共4分)
(2)Cu2++2e-="=Cu " 20 g(各2分,共4分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解。(各2分,共4分)
略

练习册系列答案
相关题目
 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。 度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低) 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。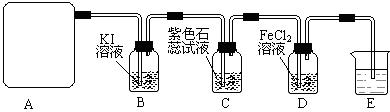
 步骤)
步骤) __________________________ ______________
__________________________ ______________