题目内容
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )分析:a与电源正极相连,为阳极,则b为阴极,甲中阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag;乙中c为阳极,发生2Cl--2e-=Cl2↑,d为阴极发生2H++2e-=H2↑,以此来解答.
解答:解:A.通电一段时间后,甲中阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,反应后为硝酸,滴加紫色的石蕊试液,溶液会变红,故A正确;
B.乙烧杯中的d电极反应式为2H++2e-=H2↑,故B错误;
C.当电解一段时间后,甲可能为硝酸,乙为KOH,则二者混合不会生成沉淀,故C错误;
D.b极增重5.4g时,n(Ag)=
=0.05mol,由2Ag~2e-~H2↑,则d极产生的气体为0.025mol×22.4L/mol=0.56L,故D错误;
故选A.
B.乙烧杯中的d电极反应式为2H++2e-=H2↑,故B错误;
C.当电解一段时间后,甲可能为硝酸,乙为KOH,则二者混合不会生成沉淀,故C错误;
D.b极增重5.4g时,n(Ag)=
| 5.4g |
| 108g/mol |
故选A.
点评:本题考查电解原理,明确发生的电极反应是解答本题的关键,注意图中阳极的判断及溶液中离子的放电顺序即可解答,题目难度中等.

练习册系列答案
相关题目


 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )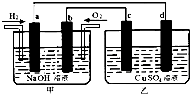 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( ) 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: