题目内容
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.

(1)A、B、C三个装置中属于电解池的是
(2)A池中Cu是
(3)B池中C电极上发生
(4)C池中Cu是

(1)A、B、C三个装置中属于电解池的是
BC
BC
.(2)A池中Cu是
正
正
极,A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu
Zn+Cu2+=Zn2++Cu
.(3)B池中C电极上发生
还原
还原
反应(填“氧化”或“还原”),B池中总反应的化学方程式为CuCl2
Cl2↑+Cu
| ||
CuCl2
Cl2↑+Cu
.
| ||
(4)C池中Cu是
阳
阳
极,电极反应为Cu-2e-=Cu2+
Cu-2e-=Cu2+
.反应过程溶液中C(Cu2+)不变
不变
(填“变大”“变小”或“不变”).分析:(1)把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)该装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,锌和氯化铜发生置换反应;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接原电池正极的是阳极,连接原电池负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化.
(2)该装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,锌和氯化铜发生置换反应;
(3)电解池阴极上得电子发生还原反应,惰性材料作电极时,溶液中阴阳离子放电,阳极上氯离子放电,阴极上铜离子放电生成铜;
(4)连接原电池正极的是阳极,连接原电池负极的是阴极,阳极是活泼电极,电解池工作时,阳极材料失电子而不是溶液中阴离子失电子,根据阴阳极上发生的反应确定溶液中铜离子浓度是否变化.
解答:解:(1)BC装置都有外接电源,所以是把电能转化为化学能的装置,属于电解池,故选BC;
(2)该装置是原电池,较活泼的金属锌作负极,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(3)B电池中,C连接原电池负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,阳极上氯离子失电子发生氧化反应,所以电池反应式为:CuCl2
Cl2↑+Cu,故答案为:还原;CuCl2
Cl2↑+Cu;
(4)铜连接原电池的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变,故答案为:阳;Cu-2e-=Cu2+;不变.
(2)该装置是原电池,较活泼的金属锌作负极,铜作正极,锌和铜离子发生氧化还原反应生成锌离子和铜单质,所以A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(3)B电池中,C连接原电池负极,所以C是阴极,阴极上得电子发生还原反应,电解池工作时,阴极上铜离子得电子发生还原反应,阳极上氯离子失电子发生氧化反应,所以电池反应式为:CuCl2
| ||
| ||
(4)铜连接原电池的正极,所以是阳极,铜是活泼电极,所以电解池工作时,阳极上铜失电子生成铜离子而不是溶液中阴离子失电子,电极反应式为Cu-2e-=Cu2+,因为阳极上铜失电子进入溶液,阴极上铜离子得电子生成铜单质,阳极上溶解的铜等于阴极上析出的铜,所以溶液中铜离子浓度不变,故答案为:阳;Cu-2e-=Cu2+;不变.
点评:本题考查了原电池和电解池原理,易错题是(4),注意活泼金属作电解池阳极时,阳极上电极材料放电而不是溶液中阴离子放电,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )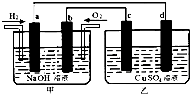 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( ) 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: