题目内容
 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )分析:根据图片知,a和c电极是阴极,b和d电极是阳极,且电极都是惰性电极,阳极上阴离子放电发生氧化反应,阴极上阳离子放电发生还原反应,根据离子放电顺序结合转移电子守恒来分析解答.
解答:解:A.如果甲、乙池分别是硝酸银、稀硫酸溶液,电解反应方程式分别为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,2H2O
2H2↑+O2↑,当转移相同物质的量的电子时,a、b、c、d四个电极上生成物的物质的量之比为:4:1:2:1,故A错误;
B.如果甲、乙池分别是硫酸铜、硝酸钠溶液时,电解反应方程式分别为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,2H2O
2H2↑+O2↑,当转移相同物质的量的电子时,a、b、c、d四个电极上生成物的物质的量之比为:2:1:2:1,故B错误;
C.如果甲、乙池分别是稀硫酸、硝酸铜溶液,电解反应方程式分别为:2H2O
2H2↑+O2↑,2Cu(NO3)2+2H2O
2Cu+O2↑+4HNO3,
当转移相同物质的量的电子时,a、b、c、d四个电极上生成物的物质的量之比为:2:1:2:1,故C错误;
D.如果甲、乙池分别是硝酸银、氯化钾溶液,电解反应方程式分别为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,2KCl+2H2O
H2↑+Cl2↑+2KOH,当转移相同物质的量的电子时,a、b、c、d四个电极上生成物的物质的量之比为:4:1:2:2,故D正确;
故选D.
| ||
| ||
B.如果甲、乙池分别是硫酸铜、硝酸钠溶液时,电解反应方程式分别为:2CuSO4+2H2O
| ||
| ||
C.如果甲、乙池分别是稀硫酸、硝酸铜溶液,电解反应方程式分别为:2H2O
| ||
| ||
当转移相同物质的量的电子时,a、b、c、d四个电极上生成物的物质的量之比为:2:1:2:1,故C错误;
D.如果甲、乙池分别是硝酸银、氯化钾溶液,电解反应方程式分别为:4AgNO3+2H2O
| ||
| ||
故选D.
点评:本题考查原电池原理,明确离子放电顺序是解本题关键,难度中等.

练习册系列答案
相关题目


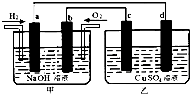 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( ) 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: