题目内容
4.CaO2•8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等.实验室先用大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙.实验流程如图1(已知:Ca(OH)2+H2O2+6H2O→CaO2•8H2O△H<0):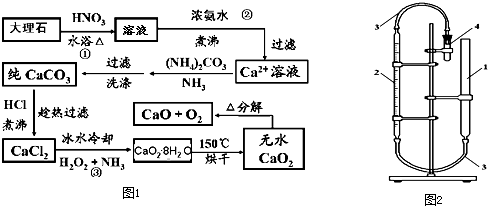
(1)写出CaO2的电子式:
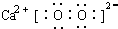 .
.(2)图示步骤②,加入浓氨水至弱碱性的目的是:使其中Mg2+、Fe3+等杂质离子形成沉淀除去.
(3)步骤③发生反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl.
(4)步骤③用冰水冷却的可能原因是:防止其分解,提高利用率,同时温度低能降低物质的溶解度,提高产率.
(5)用图2的量气法可测定样品中CaO2的质量分数:先检查装置的气密性,然后在量气管中注入一定量的水,在仪器4的试管中注入9.0g样品,连接好装置;充分加仪器4所示的小试管.若在标准状况下收集到840mL气体,则CaO2纯度为:60%.
分析 大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙的原理:大理石(含MgCO3、FeCO3等杂质)都可以和硝酸之间发生反应得到硝酸钙、硝酸镁以及硝酸铁的混合物用,FeCO3与硝酸反应是氧化还原反应,向混合液中加入氨水,可以形成氢氧化镁、氢氧化铁沉淀,过滤,得到的滤液是硝酸钙溶液(含铵根离子),向其中加入碳酸铵,发生复分解反应,可以得到碳酸钙沉淀,沉淀用盐酸溶解,得到氯化钙的水溶液,加入双氧水、氨气,冰水冷却,可以得到CaO2•8H2O,低温下烘干,可以得到CaO2,进一步加热可以得到氧化钙和氧气,
(1)CaO2是过氧根离子和钙离子通过离子键形成的离子化合物,据此书写电子式;
(2)硝酸镁、硝酸铁可以喝氨水发生复分解反应,形成氢氧化镁、氢氧化铁沉淀;
(3)根据流程图知道:氯化钙的水溶液,加入双氧水、氨气,冰水冷却,可以得到CaO2•8H2O;
(4)根据高温下双氧水以及CaO2•8H2O的性质来回答;
(5)加热发生反应:2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑,根据氧气体积计算样品中CaO2的质量,进而计算CaO2的纯度.
解答 解:大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙的原理:大理石(含MgCO3、FeCO3等杂质)都可以和硝酸之间发生反应得到硝酸钙、硝酸镁以及硝酸铁的混合物用,FeCO3与硝酸反应是氧化还原反应,向混合液中加入氨水,可以形成氢氧化镁、氢氧化铁沉淀,过滤,得到的滤液是硝酸钙溶液(含铵根离子),向其中加入碳酸铵,发生复分解反应,可以得到碳酸钙沉淀,沉淀用盐酸溶解,得到氯化钙的水溶液,加入双氧水、氨气,冰水冷却,可以得到CaO2•8H2O,低温下烘干,可以得到CaO2,进一步加热可以得到氧化钙和氧气,
(1)CaO2是过氧根离子和钙离子通过离子键形成的离子化合物,电子式为: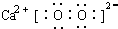 ,故答案为:
,故答案为: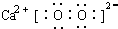 ;
;
(2)硝酸钙、硝酸镁以及硝酸铁的混合物中加入氨水,可以形成氢氧化镁、氢氧化铁沉淀,
故答案为:使其中Mg2+、Fe3+等杂质离子形成沉淀除去;
(3)氯化钙的水溶液,加入双氧水、氨气,冰水冷却,可以得到CaO2•8H2O,该反应的反应物为CaCl2、H2O2、NH3,故方程式为CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O+2NH4Cl;
(4)因为H2O2受热易分解,故采用冰水冷却的方式防止其分解,提高利用率,同时温度低能降低物质的溶解度,提高产率,
故答案为:防止其分解,提高利用率,同时温度低能降低物质的溶解度,提高产率;
(5)加热发生反应:2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑,生成氧气为$\frac{0.84L}{22.4L/mol}$=0.0375mol,故样品中CaO2的质量为0.0375mol×2×72g/mol=5.4g,则CaO2的纯度为$\frac{5.4g}{9.0g}$×100%=60%,
故答案为:60%.
点评 本题考查了制备实验方案的设计,该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 离子半径:X+>Y3+>Z2- | B. | 碱性:XOH>Y(OH)3 | ||
| C. | 单质的还原性:X>Y | D. | 原子序数:Y>X>Z |
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H20 | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L﹣1•mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
| A. | 蔗糖 | B. | 植物油 | C. | 葡萄糖 | D. | 淀粉 |
| A. | AlO2-浓度为0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| B. | 室温下,pH=11的溶液中:Na+、Ba2+、AlO2-、NO3- | |
| C. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、CO32- | |
| D. | 由水电离的H+浓度为1×10-11mol•L-1的溶液中:Mg2+、NH4+、S2O32-、SO42- |
 2NH3.下列关于该反应的说法正确的是( )
2NH3.下列关于该反应的说法正确的是( )