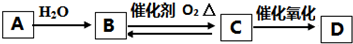题目内容
19.下列反应中,不属于四种基本反应类型的是( )| A. | CuSO4+H2S═CuS↓+H2SO4 | B. | 2FeCl3+Cu═2FeCl2+CuCl2 | ||
| C. | Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | D. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
分析 根据四种基本反应类型是指化合反应、分解反应、置换反应、复分解反应等,进行分析判断.
解答 解:A.CuSO4+H2S═CuS↓+H2SO4属于复分解反应,故A错误;
B.2FeCl3+Cu═2FeCl2+CuCl2不属于基本反应类型,故B正确;
C.Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O属于分解反应,故C错误;
D.4Fe(OH)2+O2+2H2O═4Fe(OH)3属于化合反应,故D错误.
故选B.
点评 本题考查化学基本反应类型,难度不大,掌握四种基本反应类型(化合反应、分解反应、置换反应、复分解反应)即可正确解答本题.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
9.短周期元素X、Y、Z、W、Q在表中的位置如图所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 钠与W可以形成离子化合物Na2W2 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 氧化物对应水化物的酸性:Q>W | |
| D. | 固态XY2和ZY2的化学键类型、晶体类型都相同 |
10.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大.其相关信息如下表:
(1)X的电负性比Y的小(填“大”或“小”);X 和Y的气态氢化物中,较稳定的是H2O(写化学式).
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为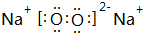 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
| 元素 | 相关信息 |
| X | X的基态原子价层电子中有两个未成对电子 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)W在周期表中的位置是第四周期第Ⅷ族,其基态原子价电子的电子排布式为3d64s2.
(3)Z2Y2的电子式为
 ,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
,请写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.(4)在XY2分子中X原子的杂化方式为sp,其分子的空间构型为直线形.氢、X、Y三种元素可共同形成多种分子和一种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:HCO3-+CH3COOH=CH3COO-+CO2↑+H2O.
7. 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
分析上述数据,回答下列问题:
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
14.把m mol乙烯跟n mol H2混合于一密闭容器中,在适当条件下反应并生成p molC2H6,若将所得混合气体燃烧,并全部生成CO2和H2O,需要氧气的物质的量为( )
| A. | 3m+n | B. | 3m+$\frac{n}{2}$ | C. | 3m+3p+$\frac{n}{2}$ | D. | 3m+$\frac{n}{2}$-3p |
4.下列说法不正确的是( )
| A. | 核素${\;}_{116}^{297}$Lv的中子数是181 | B. | 红磷和白磷互为同素异形体 | ||
| C. | CH4O和C2H6O互为同系物 | D. | 丁烷(C4H10)具有2种同分异构体 |
8.下列解释事实的离子方程式正确的是( )
| A. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O | |
| B. | Na放入水中,产生气体:Na+H2O=Na++OH-+H2↑ | |
| C. | 实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
9.下列各组顺序的排列不正确的是( )
| A. | 原子半径:F>Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<H3PO4<H2SO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |