题目内容
7.下列离子方程式正确的是( )| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+═H2O+CaCO3↓ | |
| B. | 氯化铵与氢氧化钠溶液混合:NH4++OH-═H2O+NH3↑ | |
| C. | 向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| D. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.二者反应生成一水合氨;
C.二氧化硫具有还原性,能被次氯酸根离子氧化生成硫酸根离子;
D.二价铁离子、硫离子都能够被硝酸氧化.
解答 解:A.碳酸氢钠溶液与少量石灰水反应,离子方程式:2HCO3-+2OH-+Ca2+═H2O+CaCO3↓+CO32-,故A错误;
B.氯化铵与氢氧化钠溶液混合,离子方程式:NH4++OH-═NH3•H2O,故B错误;
C.向漂白粉溶于水形成的溶液中通入少量的SO2,离子方程式:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO,故C正确;
D.硫化亚铁具有还原性,而硝酸具有氧化性,两者要发生氧化还原反应,正确的离子反应为FeS+4H++NO3-=Fe3++S↓+NO↑+2H2O,故D错误;
故选:C.
点评 本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
17.下列各组溶液,不用外加试剂,就能实现鉴别的是( )
①CuSO4 K2SO4 KNO3 KOH
②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3
④NaAlO2 Na2SiO3 H2SO4 NaCl.
①CuSO4 K2SO4 KNO3 KOH
②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3
④NaAlO2 Na2SiO3 H2SO4 NaCl.
| A. | ①②③ | B. | ①②③④ | C. | ①③④ | D. | ②③④ |
18. 纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )
纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )
 纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )
纯净物 X、Y、Z 转化关系如右图所示,下列判断不正确的是( )| A. | X 可能是金属铜 | B. | Y 可能是氢气 | ||
| C. | Z 不可能是氯化钠 | D. | Z 可能是三氧化硫 |
15.在K2SO4和KCl的混合溶液中,K+的物质的量浓度为1.2mol/L,${SO}_{4}^{2-}$的物质的量浓度为0.4mol/L,则此溶液中Cl-的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.4mol/L | C. | 0.6mol/L | D. | 0.8mol/L |
2.下列反应的离子方程式正确的是( )
| A. | 碳酸钙与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ | |
| C. | 铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液中滴加稀硫酸:Ba2++SO42-═BaSO4↓ |
16.铜和铝是日常生活和生产中重要金属,钛(Ti)有许多 的神奇功能,越来越引起人们的关注,依据三种金属的性质和用途,判断下列说法错误的是( )
| A. | 钛和钛合金放在海水中数年,取出后仍光亮如初,这说明金属钛具有很强的抗腐蚀性 | |
| B. | 将大小厚薄相同的铜铝钛分别放入盛有相同稀盐酸的试管中,观察到盛钛的试管 放出气泡缓慢,盛铝的试管放出气泡快,盛铜试管无现象,由此可推测三种金属 活动性顺序为Al>Cu>Ti | |
| C. | 铜具有良好的导电性,可用来制造电线电缆 | |
| D. | 高层建设常采用铝合金门窗而不采用铁门窗,主要因为铝密度小易形成一层致密的氧化物薄膜 |
17.下列有关尽应中不属于离子反应的是( )
| A. | Na2CO3溶液与澄清石灰水的反应 | |
| B. | 氢氧化铜与稀硫酸的反应 | |
| C. | 锌与氯化铜溶液的反应 | |
| D. | 二氧化碳与生石灰作用生成碳酸钙的反应 |

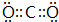 ;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.
;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.