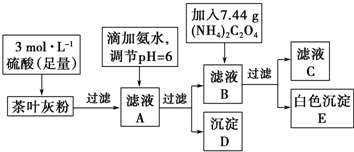
题目内容
19.某研究小组以水杨酸和甲苯为主要原料,按下列路线合成抗血栓药物--新抗凝.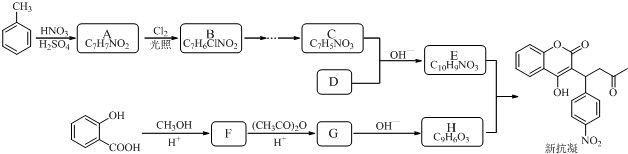
已知:
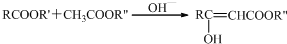
RCHO+CH3COR′$\underset{\stackrel{O{H}^{-}}{→}}{\;}$RCH═CHCOR′
请回答:
(1)同时符合下列条件的A的所有同分异构体4 种.
①红光光谱标明分子中含有
 结构;
结构;②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子.
(2)设计F→G的化学方程式
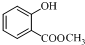 +(CH3CO)2O$\stackrel{H+}{→}$
+(CH3CO)2O$\stackrel{H+}{→}$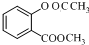 +CH3COOH.
+CH3COOH.(3)下列说法不正确的是AD.
A.化合物B能使Br2水褪色 B.化合物C能与新制氢氧化铜反应
C.化合物F能与FeCl3发生显色反应 D.新抗凝的分子式为C19H16O6
(4)写出化合物的结构简式:A
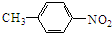 .
.(5)G→H的化学方程式是
 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$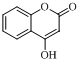 +CH3OH.
+CH3OH.
分析 由E、H分子式与新抗凝的结构简式可知,E与H发生加成反应生成新抗凝,可推知E为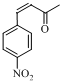 ,H为
,H为 .C与D发生信息中反应得到E,可推知C为
.C与D发生信息中反应得到E,可推知C为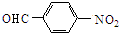 ,D为
,D为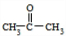 .甲苯发生甲基对位的硝化反应生成A为
.甲苯发生甲基对位的硝化反应生成A为 ,A与氯气发生取代反应生成B为
,A与氯气发生取代反应生成B为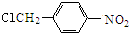 ,B发生水解反应生成
,B发生水解反应生成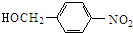 ,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为
,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为 ,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为
,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为 .
.
解答 解:由E、H分子式与新抗凝的结构简式可知,E与H发生加成反应生成新抗凝,可推知E为 ,H为
,H为 .C与D发生信息中反应得到E,可推知C为
.C与D发生信息中反应得到E,可推知C为 ,D为
,D为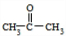 .甲苯发生甲基对位的硝化反应生成A为
.甲苯发生甲基对位的硝化反应生成A为 ,A与氯气发生取代反应生成B为
,A与氯气发生取代反应生成B为 ,B发生水解反应生成
,B发生水解反应生成 ,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为
,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为 ,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为
,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为 .
.
(1)同时符合下列条件的A( )的所有同分异构体:①红光光谱标明分子中含有
)的所有同分异构体:①红光光谱标明分子中含有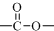 结构,说明含有羧基或酯基,②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子,符合条件的同分异构体有:
结构,说明含有羧基或酯基,②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子,符合条件的同分异构体有: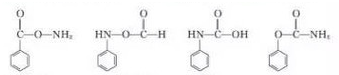 ,
,
故答案为:4;
(2)F→G的化学方程式: +(CH3CO)2O$\stackrel{H+}{→}$
+(CH3CO)2O$\stackrel{H+}{→}$ +CH3COOH,
+CH3COOH,
故答案为: +(CH3CO)2O$\stackrel{H+}{→}$
+(CH3CO)2O$\stackrel{H+}{→}$ +CH3COOH;
+CH3COOH;
(3)A.化合物B为 ,不能使Br2/CCl4溶液褪色,故A错误;
,不能使Br2/CCl4溶液褪色,故A错误;
B.化合物C为 ,含有醛基,能与新制氢氧化铜反应,故B正确;
,含有醛基,能与新制氢氧化铜反应,故B正确;
C.化合物F为 ,含有酚羟基,能与FeCl3发生显色反应,故C正确;
,含有酚羟基,能与FeCl3发生显色反应,故C正确;
D.由新抗凝的结构简式,可知其分子式为C19H15NO6,故D错误.
故选:AD;
(4)A的结构简式为: ,故答案为:
,故答案为: ;
;
(5)G→H的化学方程式是: $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ +CH3OH,
+CH3OH,
故答案为: $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ +CH3OH.
+CH3OH.
点评 本题考查有机物的推断与合成,充分利用有机物的分子式、结构简式分析,侧重考查学生分析推理能力,对信息的获取与迁移运用能力,难度中等.

①NaHCO3 ②SiO2 ③Al(OH)3 ④Al.
| A. | 全部 | B. | ①③④ | C. | ②③④ | D. | ③④ |
| A. | 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| C. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
| A. | 滴加石蕊溶液显蓝色的溶液:Na+、Fe3+、HCO3-、NO3- | |
| B. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| C. | 0.1 mol•L-1 AlCl3溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 NaAlO2溶液:H+、Na+、Cl-、SO42- |
| A. | 用食醋清洗茶壶上的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Fe(SCN)3溶液中滴NaOH溶液:Fe(SCN)3+3OH-═Fe(OH)3↓+3SCN- | |
| C. | 碳酸钠溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 钠在空气中加热燃烧:4Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2O |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)B元素在元素周期表中的位置第三周期ⅢA族.
B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示C、H形成化合物的过程:
 .
.用电子式表示G、E形成最高价化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
F、E形成原子个数比为1:1的化合物的电子式
 .
.(5)F与G形成10电子的化合物的结构式
 .
.(6)A、B、C、E形成的简单离子的半径由大到小的顺序为S2->O2->Mg2+>Al3+(填离子符号).