题目内容
下列离子反应方程式正确的是
A.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― Cu2++ SO2↑+ 2H2O
Cu2++ SO2↑+ 2H2O
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑
H2↑+C12↑
C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2 = 2Fe3++2H2O
D
【解析】
试题分析;A、浓硫酸应该用化学式表示,A错误;B、电解饱和食盐水:2Cl- +2H2O H2↑+C12↑+ 2OH-,B不正确;C、氨水不能溶解氢氧化铝,则向氯化铝溶液中加入过量氨水反应的离子方程式为Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+,C错误;D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O,D正确,答案选D。
H2↑+C12↑+ 2OH-,B不正确;C、氨水不能溶解氢氧化铝,则向氯化铝溶液中加入过量氨水反应的离子方程式为Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+,C错误;D、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2=2Fe3++2H2O,D正确,答案选D。
考点:考查离子方程式的正误判断

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(10分)氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。常用电离常数Kb和电离度α来定量表示氨水的电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
1 | 50.00 | 0.00 | 1.34×10-3 | |||
2 | 25.00 | 25.00 | 9.48×10-4 | |||
3 | 5.00 | 45.00 | 4.24×10-4 |
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb 。
。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1
的NaOH溶液和20.00mL0.10mol·L—1氨水所得的滴定曲线如图。
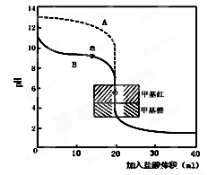
请指出盐酸滴定氨水的曲线为 (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 。
