题目内容
15.下列说法正确的是( )| A. | O2-的结构示意图为 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
分析 A.O2-核外有8个电子;
B.某微粒核外电子排布为2、8、8结构,则该微粒可能为氩原子、钾离子、氯离子等;
C.NH4+与H3O+均含有11个质子、10个电子;
D.若核外电子数相同,则电子层结构相同.
解答 解:A.O2-的结构示意图为 ,故A错误;
,故A错误;
B.某微粒核外电子排布为2、8、8结构,则该微粒可能为氩原子、钾离子、氯离子等,故B错误;
C.NH4+与H3O+均含有11个质子、10个电子,故C正确;
D.F-、Na+、Al3+与Ne原子核外均含有10个电子,具有相同电子层结构,但Ca2+核外有18个电子,与Ne原子电子层结构不相同,故D错误.
故选C.
点评 本题考查化学用语,涉及核外电子排布、原子构成等,比较基础,注意利用列举法解答.

练习册系列答案
相关题目
5.下列说法中正确的是( )
| A. | 0.1 mol•L-1NH4Cl溶液的KW大于0.01mol?L-1NH4Cl溶液的KW | |
| B. | 当镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时,升高温度,反应速率v(H2)和H2的平衡转化率α(H2)均增大 | |
| D. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 |
6.除去括号内的杂质,填上适当的试剂和方法.
| 所需试剂 | 方法 | |
| 甲烷(乙烯) | 溴水 | 洗气 |
| 苯(酒精) | 水 | 分液 |
| 粗苯甲酸的提纯 | 水 | 重结晶 |
3.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质.
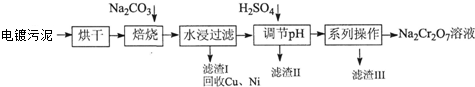
已知:①Cr(OH)3、ZnO和Al2O3一样均为两性化合物.
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如下表
(1)焙烧过程中生成Na2CrO4的化学方程式为4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2,Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2AlO3+CO2↑,ZnO++Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2ZnO2+CO2↑,水浸后溶液中除Na2CrO4、NaAlO2外还存在的溶质有Na2ZnO2,滤渣Ⅲ的主要成份为Na2SO4•10H2O.
(2)继续加入H2SO4后存在平衡:2CrO42-+2H+?Cr2O72-+H2O 不能说明反应到达平衡状态的是AD.
A.溶液的pH值保持不变 B.ν正(Cr2O72-)=2ν逆(CrO42-)
C.CrO42- 和Cr2O72-的浓度比值保持不变 D.溶液颜色保持不变
(3)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-.
①转化后所得溶液中c(Cr2O72-)=0.2mol•L-1.
②已知:T℃时该反应的平衡常数K=2×1013,上述转化后所得溶液的pH为6.4.(lg2=0.3 lg3=0.48 1g7=0.85)
(4)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为:Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.

已知:①Cr(OH)3、ZnO和Al2O3一样均为两性化合物.
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如下表
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[来源:] | 183 | 269 | 415 |
(2)继续加入H2SO4后存在平衡:2CrO42-+2H+?Cr2O72-+H2O 不能说明反应到达平衡状态的是AD.
A.溶液的pH值保持不变 B.ν正(Cr2O72-)=2ν逆(CrO42-)
C.CrO42- 和Cr2O72-的浓度比值保持不变 D.溶液颜色保持不变
(3)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-.
①转化后所得溶液中c(Cr2O72-)=0.2mol•L-1.
②已知:T℃时该反应的平衡常数K=2×1013,上述转化后所得溶液的pH为6.4.(lg2=0.3 lg3=0.48 1g7=0.85)
(4)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为:Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
10.下列说法正确的是(NA表示阿伏加德罗常数)( )
①28g N2所含有的原子数为2NA
②在常温常压下,11.2L N2含有的分子数为0.5NA
③34g氨气所含分子数为2NA
④标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA.
①28g N2所含有的原子数为2NA
②在常温常压下,11.2L N2含有的分子数为0.5NA
③34g氨气所含分子数为2NA
④标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA.
| A. | ①③ | B. | ①② | C. | ③④ | D. | ②④ |
20.下列关于Fe( OH)3胶体的说法中,不正确的是( )
| A. | 分散质粒子直径在10-9~l0-7m之间 | B. | 是一种纯净物 | ||
| C. | 具有丁达尔效应 | D. | 具有净水作用 |
7.我们在很多物质的研究中都用到了燃烧反应,你认为不正确的是( )
| A. | 燃烧一定伴有发光现象 | B. | 燃烧一定会放出热量 | ||
| C. | 燃烧一定要有氧气参加 | D. | 金属在燃烧时化合价一定升高 |
5.下表是第二、三周期元素性质的部分数据:
(1)以上9种元素中,金属性最强的是Na,非金属性最强的是F.(填元素符号)
(2)②和⑨形成的化合物是共价化合物(填“离子化合物”或“共价化合物”).
(3)①、②与氢元素能形成一种常见的有机物,这种物质常用于医疗消毒.在空气中,将灼热的铜丝插入该物质,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(4)16g铜金合金与足量的某浓度的⑧的最高价氧化物对应的水化物反应,将产生的气体与1.12L(标准状况)O2混合,通入水中,气体恰好完全被吸收,重新生成⑧的最高价氧化物对应的水化物.该合金中铜的质量分数为40%.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径/10-10 m | 0.74 | 0.77 | 1.52 | 1.02 | 1.10 | 0.71 | 1.86 | 0.75 | 0.99 |
| 最高化合价 | - | +4 | +1 | +6 | +5 | - | +1 | +5 | +7 |
| 最低化合价 | -2 | -4 | - | -2 | -3 | -1 | - | -3 | -1 |
(2)②和⑨形成的化合物是共价化合物(填“离子化合物”或“共价化合物”).
(3)①、②与氢元素能形成一种常见的有机物,这种物质常用于医疗消毒.在空气中,将灼热的铜丝插入该物质,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(4)16g铜金合金与足量的某浓度的⑧的最高价氧化物对应的水化物反应,将产生的气体与1.12L(标准状况)O2混合,通入水中,气体恰好完全被吸收,重新生成⑧的最高价氧化物对应的水化物.该合金中铜的质量分数为40%.