题目内容
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A、1LpH=12的Ca(OH)2溶液中含阴离子0.02NA |
| B、标准状况下,NA个己烷分子所占的体积约为22.4 L |
| C、0.1mol氯气与足量的金属铁反应,转移的电子总数为0.3NA |
| D、20g重水(2H216O)含有的电子数为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、1LpH=12的Ca(OH)2溶液C(OH-)=10-2mol/L,根据n=CV计算出OH-的个数;
B、标况下,己烷为液态;
C、根据氯气反应后氯元素的价态来分析;
D、根据n=
求出重水的物质的量,然后根据1mol重水含10mol电子来分析.
B、标况下,己烷为液态;
C、根据氯气反应后氯元素的价态来分析;
D、根据n=
| m |
| M |
解答:
解:A、1LpH=12的Ca(OH)2溶液C(OH-)=10-2mol/L,故氢氧根的物质的量n=CV=0.01mol/L×1L=0.01mol,OH-的个数为0.01NA个,故A错误;
B、标况下,己烷为液态,故B错误;
C、氯气反应后氯元素的价态为-1价,故0.1mol氯气转移0.2mol电子,故C错误;
D、重水的物质的量n=
=
=1mol,而1mol重水含10mol电子,故含有的电子数为10NA个,故D正确.
故选D.
B、标况下,己烷为液态,故B错误;
C、氯气反应后氯元素的价态为-1价,故0.1mol氯气转移0.2mol电子,故C错误;
D、重水的物质的量n=
| m |
| M |
| 20g |
| 20g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
饮用水的消毒剂有多种,其中杀菌能力强又不影响水质的理想消毒剂是( )
| A、臭氧(O3) |
| B、漂白剂 |
| C、苯酚 |
| D、氯气 |
胶体区别于其他分散系的本质特征是( )
| A、光束穿过胶体时形成一条光亮的“通路” |
| B、胶体粒子大小在1 nm~100 nm之间 |
| C、胶体有电泳现象 |
| D、胶体粒子不能透过半透膜 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )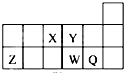

| A、元素X与元素Z的最高正化合价之和的数值等于7 |
| B、原子半径的大小顺序为:rZ>rW>rQ>rY>rX |
| C、离子Y2-和Z3+的核外电子数、电子层数和质子数都相同 |
| D、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、密闭容器中,0.1 molN2和0.3mol H2在催化剂作用下充分反应生成NH3分子数为0.2NA |
| B、1 mol过氧化钠投入足量水中,反应后转移的电子数目为NA |
| C、在0.1 mol?L-1的碳酸钾溶液中,阴离子数目大于0.1NA |
| D、4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5 NA |
下列物质不属于有机物的是( )
| A、C2H6O |
| B、C2H4O2 |
| C、C6H6O |
| D、KSCN |
我国“嫦娥一号”顺利进入绕月轨道,实现绕月探测.据科学家预测月球的土壤中吸附着数百万吨的
He,而在地球上氦元素主要以
He的形式存在.关于
He和
He的叙述中正确的是( )
| ||
| 2 |
| ||
| 2 |
| ||
| 2 |
| ||
| 2 |
A、
| ||||||||
B、
| ||||||||
C、
| ||||||||
D、
|