题目内容
19.在一定条件下,可逆反应N2+3H2?2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压、v正、v逆都增大,且v正大于v逆 | |
| C. | 降温,v正、v逆减小,且v正小于v逆 | |
| D. | 体积不变,加入氮气,v正、v逆都增大,且v正大于v逆 |
分析 由反应的热化学方程式N2+3H2?2NH3(正反应是放热反应)可知,反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,平衡向正反应方向移动;正反应放热,则升高温度平衡向逆反应方向移动,以此解答该题.
解答 解:A.加入催化剂,正逆反应速率都增大,且增大的倍数相同,平衡不移动,故A正确;
B.反应物气体的化学计量数大于生成物气体的化学计量数,增大压强,v(正)、v(逆)都增大,平衡向正反应方向移动,说明v(正)增大的倍数大于v(逆)增大的倍数,故B正确;
C.正反应放热,则降低温度平衡向正反应方向移动,正逆反应速率都减小,则v正大于v逆,故C错误;
D.加入氮气,反应物浓度增大,v正、v逆都增大,且v正大于v逆,平衡正向移动,故D正确.
故选C.
点评 本题考查化学反应速率以及化学平衡移动的影响因素,为高频考点,题目难度中等,本题注意结合外界条件对化学平衡的移动,判断移动方向,进而比较正逆反应速率关系.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
9.电离平衡常数是衡量弱电解质电离程度的量.已知如下表数据(25℃):
(1)25℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
10.苹果切开不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物.则这种空气中常见的氧化剂可能是( )
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
14.在一密闭容器中发生反应:2X(g)+Y(g)?aZ(g)△H=QkJ•mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应.图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )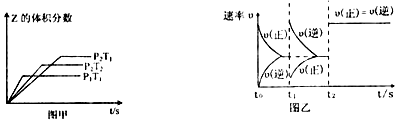

| A. | 图甲,P1>P2,a<3 | |
| B. | 图甲,T1<T2,Q>0 | |
| C. | 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 | |
| D. | 图乙,如果a=3,t2时表示向体系中加入了催化剂 |
11.化学与社会、生产、生活密切相关,下列说法正确的是( )
| A. | 氢氧化铝、氢氧化钠都是常见的胃酸中和剂 | |
| B. | 海轮外壳镶嵌锌块是利用牺牲阳极的阴极保护法 | |
| C. | 水泥、玛瑙、分子筛都是硅酸盐工业产品 | |
| D. | 明矾净水时的作用是杀菌、消毒 |
8.下列说法不正确的是( )
| A. | 可用氢氟酸刻蚀玻璃 | B. | 硅胶可作食品干燥剂 | ||
| C. | 硅酸钠可作木材防火剂 | D. | 二氧化硅可作太阳能电池板 |
9.下列说法正确的是( )
| A. | 氯气和二氧化硫都有漂白性,等体积的二者混合会提高漂白效率 | |
| B. | 氢氧化铁胶体在电场的作用下向阳极移动 | |
| C. | 普通玻璃中含有石英、石灰石和纯碱 | |
| D. | 铝制餐具不宜用来长时间存放酸性、碱性或咸的食物 |