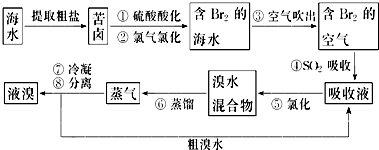
题目内容
5.求25℃时以下溶液的pH(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH=3.3.
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH=11.7.
(3)pH=12的NaOH和pH=2的HCl等体积混合后,pH=7.
分析 (1)根据混合溶液的氢离子浓度计算;
(2)先根据混合溶液的氢氧根离子浓度,再结合离子积常数计算氢离子浓度,根据溶液pH的公式计算;
(3)先计算判断氢离子和氢氧根离子的物质的量相对大小,再根据溶液的酸碱性计算溶液的pH.
解答 解:(1)设两种酸的体积都是1L,pH=3的盐酸与pH=5的硫酸等体积混合后,混合溶液中氢离子浓度=$\frac{1{0}^{-3}+1{0}^{-5}}{2}$=5.05×10-4 mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
故答案为:3.3;
(2)设两种碱的体积都是1L,pH=10和pH=12的两种NaOH溶液等体积混合后,混合溶液中氢氧根离子浓度=$\frac{1{0}^{-2}+1{0}^{-4}}{2}$mol/L=5.05×10-3 mol/L,则混合溶液中氢离子浓度=$\frac{1{0}^{-14}}{5.05×1{0}^{-3}}$mol/L=2×10-12mol/L,pH=11.7,
故答案为:11.7;
(3)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=2的HCl中c(H+)=0.01mol/L,等体积混合后,酸和碱的物质的量相等,则溶液呈中性,pH=7,
故答案为:7.
点评 本题考查了pH的简单计算,先计算溶液中氢离子浓度,再根据pH公式计算溶液的pH值,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列装置所示的实验能达到实验目的是( )
| A. |  制备Fe(OH)2并观察颜色 | B. |  分离碘酒中的碘和酒精 | ||
| C. |  除去Cl2中的HCl | D. |  定容 |
16.化合物 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )
 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:2:2:1:6 | B. | 3:4:1:3:3 | C. | 9:4:1 | D. | 3:4:7 |
13.常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
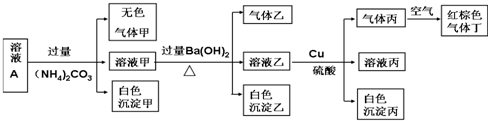

| A. | 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定没有Fe3+,但是无法确定是否含有I- |
17.用惰性电极插入KOH溶液中,在两极分别通入CH3OH和O2,有关此电池判断正确的是( )
| A. | 正极反应式:2CH3OH+2H2O-12e-═2CO2↑+12H+ | |
| B. | 放电一段时间后,负极的PH值升高 | |
| C. | 放电一段时间,阳离子向负极移动,阴离子向正极移动 | |
| D. | 该电池在工作时,每消耗32gCH3OH,外电路中通过6mole- |
14.美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法不正确的是( )

| A. | CO2属于酸性氧化物 | |
| B. | CO与O形成化学键的过程中放出能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键的过程中有电子转移 |
15.核电荷数为1~18的元素中,下列叙述正确的是( )
| A. | 最外层只有1个电子的原子一定是金属元素的原子 | |
| B. | 最外层只有2个电子的原子一定是金属元素的原子 | |
| C. | 原子核外各电子层电子数相等的原子一定是金属元素的原子 | |
| D. | 最外层电子数最多的原子最容易获得电子 |