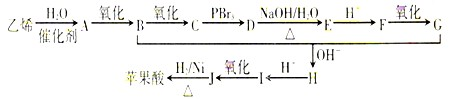
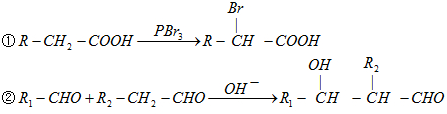题目内容
设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4LCH2Cl2中含C-Cl键数目为0.2NA |
| B、常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA |
| C、常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
| D、常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,CH2Cl2是液体;
B.水溶液中水中也含氧原子;
C.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子;
D.尿素和乙酸的含氢量相同.
B.水溶液中水中也含氧原子;
C.过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子;
D.尿素和乙酸的含氢量相同.
解答:
解:A.标准状况下,CH2Cl2是液体,22.4L不是1mol,故A错误;
B.溶剂水中含有氧原子,10g92%酒精水溶液含氧原子总数大于0.2NA,故B错误;
C.0.1molNa2O2与水完全反应转移电子数为0.1NA,故C错误;
D.尿素和乙酸的含氢量相同,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA,故D正确.
故选D.
B.溶剂水中含有氧原子,10g92%酒精水溶液含氧原子总数大于0.2NA,故B错误;
C.0.1molNa2O2与水完全反应转移电子数为0.1NA,故C错误;
D.尿素和乙酸的含氢量相同,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA,故D正确.
故选D.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液呈( )
| A、碱性 | B、酸性 |
| C、中性 | D、无法确定 |
将a%的某物质的水溶液加热蒸发掉m g水(溶质不挥发、且蒸发过程无溶质析出),所得溶液体积为V L,溶质的质量分数为蒸发前的2倍,设溶质的相对分子质量为M,则蒸发后所得溶液的物质的量浓度为( )mol/L.
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质属于纯净物的是( )
| A、稀硫酸 | B、NaOH |
| C、液化石油气 | D、天然气 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、含4.8g 碳元素的石墨晶体中的共价键数是0.8NA |
| B、标准状况下,11.2LCO和N2的混合气体中,含有的原子数为NA |
| C、1mol的羟基(-OH)与1mol的氢氧根离子(OH-)所含电子数均为9NA |
| D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反 应后的生成物分子数为NA |
搜狐网曾报道,中国每年要进口5亿吨左右的铁矿石,占世界海上铁矿石贸易量的一半以上,随着全球铁矿石价格的上涨,中国钢铁工业协会与澳大利亚必和必拓公司谈判陷入困境,关于铁矿石说法正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁矿石的主要成分与铁锈的主要成分相同 |
| C、磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色 |
| D、FeO俗称铁红 |