题目内容
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)△H<0 体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K= ;
(2)用O2表示从0~2s内该反应的平均速率ν(O2)= .
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率ν(O2)=
考点:用化学平衡常数进行计算,反应速率的定量表示方法
专题:
分析:(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积;
(2)根据v=
计算v(NO),再利用速率之比等于化学计量数之比计算v(O2).
(2)根据v=
| △c |
| △t |
解答:
解:(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,K=
,故答案为:
;
(2)2s内用NO表示的平均反应速率v(NO)=
=
=3.0×10-3mol?L-1?s-1,速率之比等于化学计量数之比,所以v(O2)=
v(NO)=
×3.0×10-3mol?L-1?s-1=1.5×10-3mol?L-1?s-1,故答案为:1.5×10-3mol?L-1?s-1.
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
(2)2s内用NO表示的平均反应速率v(NO)=
| ||
| △t |
| ||
| 2s |
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查化学平衡常数表达式的书写和化学反应的速率的计算,根据表格只能求NO的速率,然后根据速率之比等于化学计量数之比,从而求出氧气的速率.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
将AlCl3溶液中的Al3+沉淀出来,最好加入的试剂是( )
| A、氨水 |
| B、NaOH溶液 |
| C、Na2SO4溶液 |
| D、AgNO3溶液 |
制备乙酸乙酯的绿色合成路线之一为:
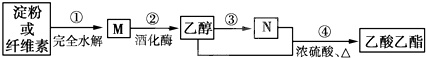
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、用NaOH溶液可除去乙酸乙酯中混有的乙酸 |
| C、①、④的反应类型均属于取代反应 |
| D、N的化学式为CH3COOH |

 如图在甲处的试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入5mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在乙处的试管中加入5mL饱和碳酸钠溶液,按图连接好装置,用酒精灯对甲处的试管缓慢加热,当观察到乙处的试管中有明显现象时停止实验.请回答:
如图在甲处的试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入5mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在乙处的试管中加入5mL饱和碳酸钠溶液,按图连接好装置,用酒精灯对甲处的试管缓慢加热,当观察到乙处的试管中有明显现象时停止实验.请回答: