题目内容
下列的叙述中不正确的是
[ ]
A.卤化氢分子中,卤素的非金属越强,共价键的极性越强,稳定性也强,而分子间作用力越小
B.分子作用力越大的,它的化学性质越稳定
C.判断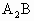 或
或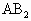 型分子是否是极性分子的依据是:具有极性键且分子构型不对称、键角小于
型分子是否是极性分子的依据是:具有极性键且分子构型不对称、键角小于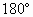 的非直线型结构
的非直线型结构
D.非极性分子中,各原子间都应以非极性键结合
答案:BD
提示:
提示:
|
对比 HF、HCl、HBr、HI分子中H-X极性键强弱,卤素中非金属性越强的键长短、极性键强是对的,而分子间作用力对同一类型的分子来说,质量大的作用力就强,也是对的.化学性质的稳定性取决于化学键的键能与分子间作用力无关.
都以非极性键结合的双原子分子自然是非极性分子,对多原子分子来讲,可以是极性键构成但构型对称,即分子中正电荷负电荷的重心完全重合,也可以构成非极性分子. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列的叙述中不正确的是( )
| A、氯气是一种黄绿色,有刺激性气味的气体 | B、将钠保存在水中 | C、氯气能溶于水 | D、将一小块钠放在石棉网上加热,观察现象察现象 |
金属钛( 22Ti )被称为未来钢铁.钛有46Ti、47Ti、48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
| A、上述钛原子中,中子数不可能为22 | B、钛元素在周期表中处于第四周期 | C、钛的各种同位素在周期表中处于不同的位置 | D、钛的各种同位素化学性质几乎相同 |
某温度下,向pH=6的蒸馏水中,加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述中不正确的是( )
| A、该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 | B、由水电离出来的H+的浓度是1.0×10-10mol/L | C、加入NaHSO4晶体抑制了水的电离 | D、该温度高于25℃ |
 型如
型如 、
、 等,
等, 型如
型如 、
、 、
、 、等,判断其是否是极性分子的根据是必有极性键且电荷分布不对称.如HCl、
、等,判断其是否是极性分子的根据是必有极性键且电荷分布不对称.如HCl、 、
、 ,直线型指HCl、
,直线型指HCl、 、
、 ,结构式为H-Cl、O=C=O、S=C=S,直线型中HCl电荷分布不对称为极性分子,而
,结构式为H-Cl、O=C=O、S=C=S,直线型中HCl电荷分布不对称为极性分子,而 、
、 直线型
直线型 键角,电荷分布对称为非极性分子.
键角,电荷分布对称为非极性分子.