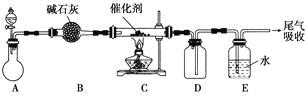
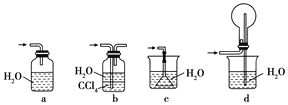
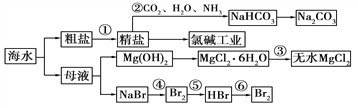
��Ŀ����
����Ŀ��ij�¶��£��ܱ������з������¿��淴Ӧ��2E(g)![]() F(g)��xG(g) ��H<0������ʼʱE��Ũ��Ϊa mol��L1��F��G��Ũ�Ⱦ�Ϊ0���ﵽƽ��ʱE��Ũ��Ϊ0.5a mol��L1����E����ʼŨ��Ϊ2a mol��L1��F��GŨ����Ϊ0�����ﵽ�µ�ƽ��ʱ������˵����ȷ����
F(g)��xG(g) ��H<0������ʼʱE��Ũ��Ϊa mol��L1��F��G��Ũ�Ⱦ�Ϊ0���ﵽƽ��ʱE��Ũ��Ϊ0.5a mol��L1����E����ʼŨ��Ϊ2a mol��L1��F��GŨ����Ϊ0�����ﵽ�µ�ƽ��ʱ������˵����ȷ����
A�������¶�ʱ������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
B����x��1������������ֲ��䣬��ƽ����E���������Ϊ50%
C����x��2������������ֲ��䣬��ƽ����F��ƽ��Ũ��Ϊ0.5a mol��L1
D����x��3������ѹǿ���ֲ��䣬��ƽ����E�����ʵ���Ϊa mol
���𰸡�B
�������������¶�ʱ�������淴Ӧ���ʶ��ӿ죬��A�����B���x=1����Ӧǰ��������䣬�������������������ƽ���ǵ�Ч�ģ�����ͬ�ɷֵİٷֺ�������ͬ����B��ȷ��C���x=2����Ӧ���������Ŀ��淴Ӧ����E����ʼŨ�ȸ�Ϊ2a mol��L-1���൱������ѹǿ��ƽ�����淴Ӧ�����ƶ���������ƽ����F��ƽ��Ũ��С��0.5a mol��L-1����C����֪�������������������E�����ʵ�������D����

��ϰ��ϵ�д�
�����Ŀ