题目内容
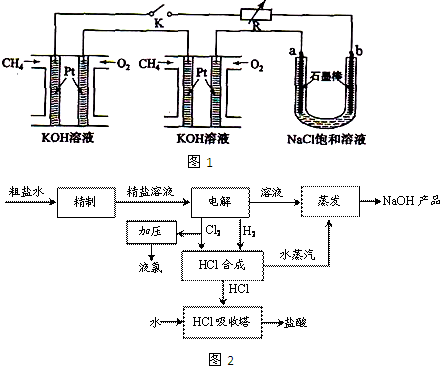
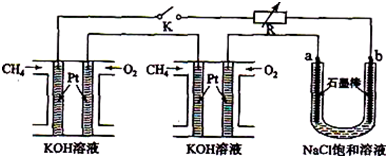
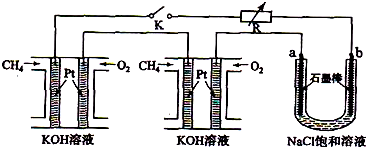
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和氯化钠溶液实验,如图所示.
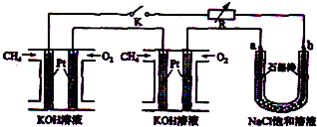
回答下列问题:
(1)闭合K开关后,u型管中a、b电极上均有气体产生,其中a极上得到的物质是
(2)电解氯化钠溶液的总反应化学方程式为
(3)甲烷燃料电池正极、负极的电极反应分别为
(4)若每个电池甲烷通入量为2.24L(标准状况),且反应完全,则理论上通过电解池的电子的总物质的量为

回答下列问题:
(1)闭合K开关后,u型管中a、b电极上均有气体产生,其中a极上得到的物质是
氯气
氯气
,在b极上放电的离子是H+
H+
,往b极处的溶液滴入酚酞试液,能观察到b极附近的溶液变红
b极附近的溶液变红
.(2)电解氯化钠溶液的总反应化学方程式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
;
| ||
(3)甲烷燃料电池正极、负极的电极反应分别为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
、CH4+10OH--8e-═CO32-+7H2O
CH4+10OH--8e-═CO32-+7H2O
.(4)若每个电池甲烷通入量为2.24L(标准状况),且反应完全,则理论上通过电解池的电子的总物质的量为
0.8mol
0.8mol
,最多能产生的氯气体积为8.96
8.96
L(标准状况).分析:(1)甲烷燃料电池中,通甲烷的一端为负极,则a与正极相连,所以a为阳极,电解NaCl溶液时氯离子在阳极放电,氢离子在阴极放电;
(2)以石墨为电极,电解氯化钠溶液,生成NaOH、氢气、氯气;
(3)甲烷燃料电池正极上氧气得到电子,负极上甲烷失去电子,注意电解质为KOH;
(4)串联电路中,转移的电子相同,由CH4+10OH--8e-═CO32-+7H2O、2e-~Cl2↑来分析.
(2)以石墨为电极,电解氯化钠溶液,生成NaOH、氢气、氯气;
(3)甲烷燃料电池正极上氧气得到电子,负极上甲烷失去电子,注意电解质为KOH;
(4)串联电路中,转移的电子相同,由CH4+10OH--8e-═CO32-+7H2O、2e-~Cl2↑来分析.
解答:解:(1)甲烷燃料电池中,通甲烷的一端为负极,则a与正极相连,所以a为阳极,电解NaCl溶液时氯离子在阳极放电,所以a上生成氯气,H+在b电极(阴极)放电生成氢气,往b极处的溶液滴入酚酞试液,能观察到b极附近的溶液变红,
故答案为:氯气;H+;b极附近的溶液变红;
(2)以石墨为电极,电解氯化钠溶液,生成NaOH、氢气、氯气,该电解反应为2NaCl+2H2O
Cl2↑+H2↑+
2NaOH,
故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;
(3)甲烷燃料电池正极上氧气得到电子,正极反应为O2+2H2O+4e-═4OH-,负极上甲烷在碱性溶液中失去电子,电极反应为CH4+10OH--8e-═CO32-+7H2O,
故答案为:O2+2H2O+4e-═4OH-;CH4+10OH--8e-═CO32-+7H2O;
(4)甲烷通入量为2.24L(标准状况),其物质的量为
=0.1mol,串联电路中,转移的电子相同,
由CH4+10OH--8e-═CO32-+7H2O可知,0.1mol甲烷反应转移0.8mol电子,
则电解氯化钠溶液时由2e-~Cl2↑可知,转移0.8mol电子生成0.4molCl2,其标况下的体积为0.4mol×22.4L/mol=8.96L,故答案为:0.8mol;8.96.
故答案为:氯气;H+;b极附近的溶液变红;
(2)以石墨为电极,电解氯化钠溶液,生成NaOH、氢气、氯气,该电解反应为2NaCl+2H2O
| ||
2NaOH,
故答案为:2NaCl+2H2O
| ||
(3)甲烷燃料电池正极上氧气得到电子,正极反应为O2+2H2O+4e-═4OH-,负极上甲烷在碱性溶液中失去电子,电极反应为CH4+10OH--8e-═CO32-+7H2O,
故答案为:O2+2H2O+4e-═4OH-;CH4+10OH--8e-═CO32-+7H2O;
(4)甲烷通入量为2.24L(标准状况),其物质的量为
| 2.24L |
| 22.4L/mol |
由CH4+10OH--8e-═CO32-+7H2O可知,0.1mol甲烷反应转移0.8mol电子,
则电解氯化钠溶液时由2e-~Cl2↑可知,转移0.8mol电子生成0.4molCl2,其标况下的体积为0.4mol×22.4L/mol=8.96L,故答案为:0.8mol;8.96.
点评:本题考查原电池和电解池,明确碱性溶液中发生的电极反应及发生的电解反应是解答本题的关键,注意串联时转移电子相等,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目