题目内容
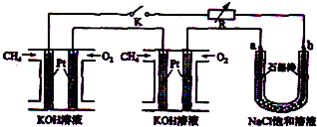
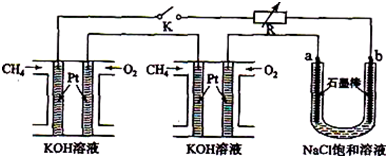
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液的电解实验,如图所示.
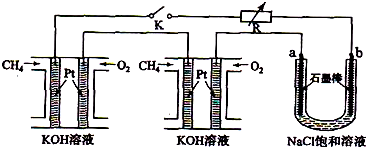
回答下列问题:
(1)甲烷燃料电池正极的电极反应式为 、负极的电极反应式为 .
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 ;若电解一段时间后,石墨棒上产生标准状况下的Cl2 224mL,电解后的溶液总体积为200mL,
则溶液的pH= .
(3)若每个电池甲烷通入量为 1L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×l04C?mol-1,列式计算),最多能产生的氯气体积为 L (标准状况).

回答下列问题:
(1)甲烷燃料电池正极的电极反应式为
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是
则溶液的pH=
(3)若每个电池甲烷通入量为 1L(标准状况),且反应完全,则理论上通过电解池的电量为
分析:(1)甲烷燃料电池中,正极发生还原反应,氧气得电子被还原,负极发生氧化反应,甲烷被氧化生成碳酸盐和水;
(2)闭合K开关后,a为阳极,b为阴极,结合电极方程式计算;
(3)根据关系式1 mol CH4~8 mol e-~4 mol Cl2计算.
(2)闭合K开关后,a为阳极,b为阴极,结合电极方程式计算;
(3)根据关系式1 mol CH4~8 mol e-~4 mol Cl2计算.
解答:解:(1)燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:2O2+4H2O+8e-=8OH-,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故答案为:2O2+8e-+4H2O=8OH-;CH4-8e-+10OH-=CO32-+7H2O;
(2)闭合K开关后,a为阳极,b为阴极,电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,电解氯化钠溶液的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
n(Cl2)=
=0.01mol/L,
由方程式可知n(NaOH)=0.02mol,
则c(OH-)=
=0.1mol/L,则pH=13,
故答案为:H2;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;13;
(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为
×8×9.65×104C?mol-1=3.45×104C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),
故答案为:
×8×9.65×104C?mol-1=3.45×104C;4.
(2)闭合K开关后,a为阳极,b为阴极,电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,电解氯化钠溶液的化学方程式为2NaCl+2H2O
| ||
n(Cl2)=
| 0.224L |
| 22.4L/mol |
由方程式可知n(NaOH)=0.02mol,
则c(OH-)=
| 0.02mol |
| 0.2L |
故答案为:H2;2NaCl+2H2O
| ||
(3)根据得失电子守恒,可得:1 mol CH4~8 mol e-~4 mol Cl2,故若每个电池甲烷通入量为1 L(标准状况),生成4L Cl2;电解池通过的电量为
| 1L |
| 22.4L/mol |
故答案为:
| 1L |
| 22.4L/mol |
点评:本题涵盖电解池和原电池的主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目