题目内容
8.某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是( )| A. | 该元素单质是导体 | |
| B. | 该元素单质在一定条件下能与盐酸反应 | |
| C. | 该元素的氧化物的水合物显碱性 | |
| D. | 该元素的最高价氧化物对应的水化物为两性 |
分析 元素的原子最外电子层排布是5s25p1,处于P区,属于第五周期第ⅢA元素,同主族自上而下金属性增强,故金属性比Al元素强,结合同族元素的相似性与递变性解答.
解答 解:元素的原子最外电子层排布是5s25p1,处于P区,属于第五周期第ⅢA元素.
A.该元素金属性比Al元素强,该元素单质是导体,故A正确;
B.金属性比Al元素强,该元素单质在一定条件下能与盐酸反应置换出氢气,故B正确;
C.氢氧化铝显弱碱性,该元素金属性比Al元素强,故氢氧化物的碱性比氢氧化铝强,故C正确;
D.同主族自上而下金属性增强,该元素的最高价氧化物对应的水化物的碱性增强,推测该元素的最高价氧化物对应的水化物只能显碱性,故D错误;
故选D.
点评 本题考查结构位置性质关系、元素周期律、核外电子排布规律等,难度不大,注意根据核外电子排布式确定元素在周期表中的位置以及同主族元素的相似性与递变性规律.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
11.下列关于化学反应的认识,错误的是( )
| A. | 会引起化学键的变化 | B. | 必然引起物质状态的变化 | ||
| C. | 会产生新物质 | D. | 必然伴随着能量的变化 |
16.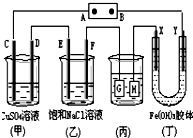 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A. | 电源B极是正极 | |
| B. | 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷 | |
| C. | 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液 | |
| D. | (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2 |
13.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1验装置进行铝热反应,冷却后得到“铁块”混合物.
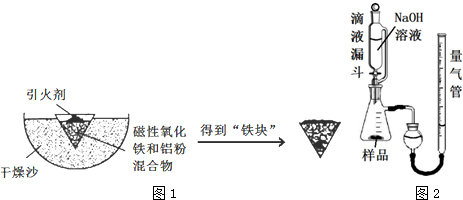
(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
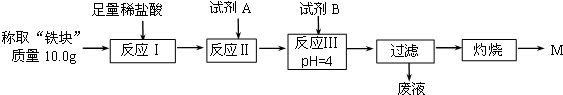
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会
偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
[]
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
17.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
18. 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+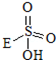 →
→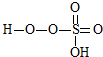 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)
(4)F位于d区,价电子排布式为3d54s1.
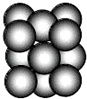
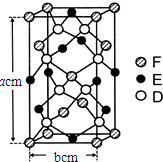
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}π}{6}$.
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
 →
→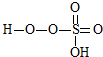 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)(4)F位于d区,价电子排布式为3d54s1.
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}π}{6}$.
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.