题目内容
【题目】下列对实验操作及结论的描述不正确的是( )
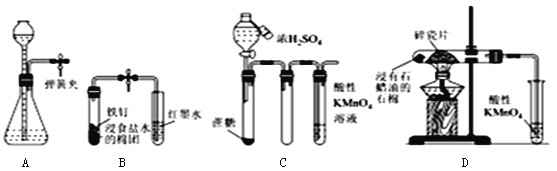
A. 夹紧弹簧夹,由长颈漏斗加水至产生液面差,一段时间后液面差不变,说明气密性良好
B. 打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C. 滴加浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化硫
D. 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
【答案】D
【解析】试题分析:A.实验前检查该装置气密性的方法是:打开旋塞,从长颈漏斗口注水至液面高于漏斗下端,关闭止水夹,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好,故A正确;B.红墨水倒吸入导气管中,说明左侧试管内压强减小,说明铁发生吸氧腐蚀,故B正确;C.二氧化碳与高锰酸钾不反应,应生成二氧化硫,故C正确;D.乙烯可被酸性高锰酸钾氧化,但加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了烯烃,故D错误;故选D。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目