题目内容
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
| A、两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol?L-1 |
| B、醋酸浓度为硫酸浓度的2倍 |
| C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D、分别加入足量锌片,两种溶液生成H2的体积相同 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、pH均为3的醋酸和硫酸,溶液中氢离子浓度为1×10-3mol/L,根据Kw=c(H+)?c(OH-)计算溶液中c(OH-),溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-),硫酸溶液中c(H+)=2c(SO42-),据此判断;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸.
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-),硫酸溶液中c(H+)=2c(SO42-),据此判断;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸.
解答:
解:A、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10-3mol/L,溶液中氢氧根浓度均为c(OH-)=
=1×10-11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10-11mol?L-1,故A正确;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,不能完全电离,其pH相等,醋酸浓度应大于硫酸,但无法确定具体倍数,故B错误;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)=1×10-3mol/L,硫酸溶液中c(H+)=2c(SO42-)=1×10-3mol/L,故c(SO42-)=5×10-4mol/L,故C错误;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,况且,没有说明溶液体积,无法比较,故D错误;
故选A
| 10-14 |
| 10-3 |
B、硫酸是强电解质,完全电离,醋酸是弱电解质,不能完全电离,其pH相等,醋酸浓度应大于硫酸,但无法确定具体倍数,故B错误;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)=1×10-3mol/L,硫酸溶液中c(H+)=2c(SO42-)=1×10-3mol/L,故c(SO42-)=5×10-4mol/L,故C错误;
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,况且,没有说明溶液体积,无法比较,故D错误;
故选A
点评:考查弱电解质的电离、溶液pH的有关计算等,难度不大,注意弱电解质的电离存在平衡,电离程度很小.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
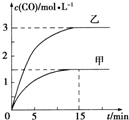 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
化学与生活密切相关,下列有关说法正确的是( )
| A、糖类、油脂、蛋白质属于天然高分子化合物 |
| B、维生素C具有还原性,在人体内起抗氧化作用 |
| C、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
下列有关溶液组成的描述合理的是( )
| A、在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN- | ||
| B、c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3- | ||
C、加水稀释时
| ||
| D、在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
温度不变恒容的容器中进行反应A?B,若反应物浓度由0.1mol?L-1降到0.06mol?L-1需20s,那么由0.06mol?L-1降到0.036mol?L-1所需反应时间应为( )
| A、等于10s |
| B、等于12s |
| C、大于12s |
| D、小于12s |
如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )

| A、①<②<③<④ |
| B、②<①<③<④ |
| C、②<①<④<③ |
| D、①<②<④<③ |
某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是( )
| A、一定形成共价键 |
| B、一定形成离子键 |
| C、可能形成共价键,也可能形成离子键 |
| D、以上说法都不对 |
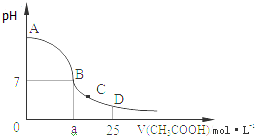 现有常温下的六份溶液:
现有常温下的六份溶液: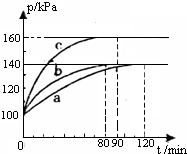 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.