题目内容
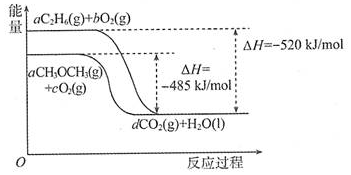
12.燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物).污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)工业上可用CO2和H2反应合成甲醇.已知25°C、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H1=-242kJ/mol
CH3OH+$\frac{3}{2}$O2(g)=CO2(g)+2H2O△H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.
(2)工业上还可以通过下列反应制备甲醇:CO (g)+2H2 (g)?CH3OH (g).在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
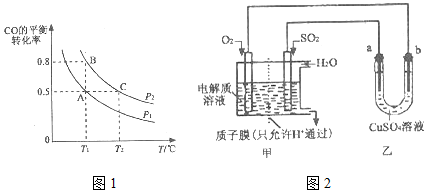
①下列说法不能判断该反应达到化学平衡状态的是ac(填字母).
a.H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA<PB(填“>”“<”或“=’’).
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10mol CO和20molH2,则在平衡状态B时容器的体积V(B)=4L.
(3)SO2在一定条件下可与氧气构成原电池.图2是利用该电池在铁表面镀铜的装置示意图:
①该电池的负极反应:SO2-2e-+2H2O=4H++SO42-;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重12.8g.
分析 (1)根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
(2)①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大;
③A、B温度相同,平衡常数相同,若达到化学平衡状态A时,容器的体积为20L,CO转化率为50%,则转化的CO为10mol×50%=5mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{20}}{\frac{5}{20}×(\frac{10}{20})^{2}}$=4,
计算B状态时各组分物质的量,再结合平衡常数计算体积;
(3)①燃料SO2为负极失电子发生氧化反应据此书写电极反应方程式;
②根据得失电子守恒进行计算.
解答 解:(1)H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H1=-242kJ/mol①;
CH3OH+$\frac{3}{2}$O2(g)=CO2(g)+2H2O△H2=-676kJ/mol②,①×3-②得,CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50 kJ/mol,故CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式为CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50 kJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50 kJ/mol;
(2)①a.H2的消耗速率等于CH3OH的生成速率的2倍,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡,当H2的消耗速率等于CH3OH的消耗速率的2倍时,反应到达平衡,故a错误;
b.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故b正确;
c.氢气、CO的转化率与它们起始物质的量有关,平衡时不一定相等,若起始物质的量之比等于化学计算量之比,转化率始终相等,故c错误;
d.混合气体总质量不变,随反应进行,混合气体总物质的量减小,平均摩尔质量增大,混合气体气体的平均摩尔质量不再改变,说明达到了平衡,故d正确.
故答案为:ac;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大,故压强PA<PB,
故答案为:<;
③若达到化学平衡状态A时,容器的体积为20L,CO转化率为50%,则转化的CO为10mol×50%=5mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{5}{20}}{\frac{5}{20}×(\frac{10}{20})^{2}}$=4,
如果反应开始时仍充入10molCO和20molH2,在平衡状态B时CO转化率为80%,则转化的CO为10mol×80%=8mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):8 16 8
平衡量(mol):2 4 8
设体积为VL,则$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=4,解得V=4,
故答案为:4;
(3)①燃料SO2为负极失电子发生氧化反应,故电极反应方程式为SO2-2e-+2H2O=4H++SO42-,
故答案为:SO2-2e-+2H2O=4H++SO42-;
②当甲中消耗2.24LO2(标准状况)时,失去电子的物质的量为$\frac{2.24L}{22.4L/mol}$×4=0.4mol,则电解法阴极,即a电极得到电子的物质的量为0.4mol,故析出铜的质量为$\frac{0.4mol}{2}$×64g/mol=12.8g,
故答案为:12.8.
点评 本题考查热化学方程式的书写、平衡状态判断、盖斯定律应用、原电池电极方程式的书写等,题目比较综合,需学生具备扎实的基础,是对学生综合能力的考查,(3)中体积计算为难点,注意掌握平衡常数应用,难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案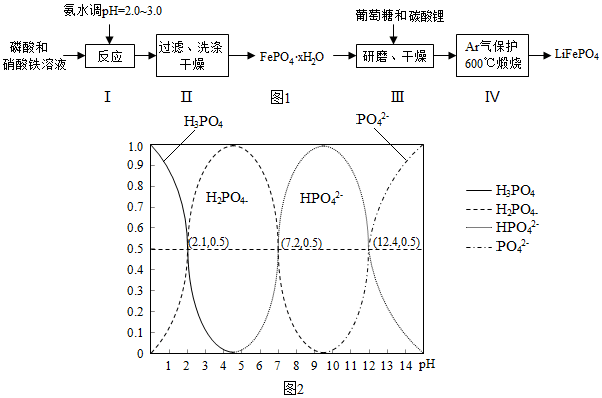
已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.
| A. | 乙酸乙酯 水 | B. | 苯 水 | C. | 乙醇 水 | D. | 四氯化碳 碘水 |
| A. | H2S、H2SO3、I-、Br- | B. | I-、Br-、H2SO3、H2S | ||
| C. | Br-、I-、H2SO3、H2S | D. | I-、Br-、H2S、H2SO3 |
| A. | K2O2 | B. | RbHCO3 | C. | Na2O | D. | LiOH |
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |
| S | Cl |
| Se | Br |
| A. | 还原性:Se2->S2->Cl- | B. | 热稳定性:HCl>H2Se>HBr | ||
| C. | 原子半径:Se>Cl>S | D. | 酸性:HBrO4>HClO4>H2SeO4 |
 表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+
表示某带电微粒的结构示意图,则可用它表示的阳离子中原子序数最大的是(写离子符号)Al3+(2)短周期元素X能形成H2X和XO2两种化合物,该元素的原子序数是16
(3)下表中,G元素原子最容易与哪种元素的原子间反应形成离子键NaCl (填离子化合物的化学式)
| 原子 | a | b | c | d | e | f | G |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |