题目内容
10.硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取MgSO4•7H2O的工艺流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

分析 (1)配制硫酸溶液需要用到烧杯、量筒、玻璃棒、容量瓶以及胶头滴管等容器;
(2)加入的NaClO可与Mn2+反应生成MnO2,SiO2不反应,则滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有MnO2、SiO2,
(3)溶液经蒸发、浓缩、结晶、过滤后可得到晶体;
(4)溶液中含有Mn2+、Fe2+,具有还原性,可与NaClO发生氧化还原反应;
(5))[Al(OH)]2+与H+结合,可转化为[Al(OH)]+;
(6)向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,证明银做原电池负极,发生的反应为铁离子氧化为银;实验可知银离子具有强氧化性氧化亚铁离子为铁离子.
解答 解:(1)配制硫酸溶液需要用到烧杯、量筒、玻璃棒、100mL容量瓶以及胶头滴管等容器,
故答案为:烧杯、100mL容量瓶;
(2)加入的NaClO可与Mn2+反应生成MnO2,SiO2不反应,则滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有MnO2、SiO2,
故答案为:MnO2、SiO2;
(3)溶液经蒸发、浓缩、结晶、过滤后可得到晶体,故答案为:过滤(或过滤洗涤);
(4)溶液中含有Mn2+、Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(5)[Al(OH)]2+与H+结合,可转化为[Al(OH)]+,离子方程式为[Al(OH)]2++H+=[Al(OH)]++H2O,
故答案为:[Al(OH)]2++H+=[Al(OH)]++H2O;
(6)向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+?Fe3++Ag;
故答案为:负;Fe2++Ag+?Fe3++Ag.
点评 本题考查物质的制备、除杂,涉及物质的检验以及沉淀的转化等知识,题目较为综合,有一定难度,本题注意要认真分析题中数据,考查学生的分析能力.

| A. | 11和8 | B. | 12和17 | C. | 11和18 | D. | 8和12 |
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价)
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种使水快速分解成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 雾霾中含有大量的PM2.5,PM2.5又称为“细颗粒物”,它容易附着有毒有害物质,尤其是重金属,对人体造成危害 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
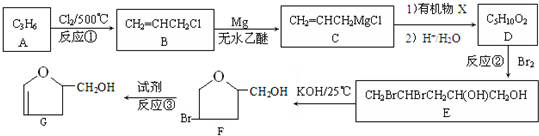
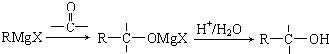
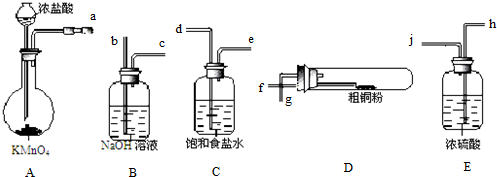
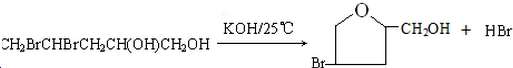 (或
(或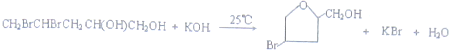 );;
);;

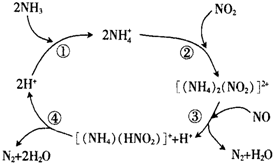 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.


