题目内容
1.下列说法不正确的是( )| A. | 焦炭在高温下与水蒸气的反应是吸热反应 | |
| B. | 氢氧化钾与硝酸的反应是放热反应 | |
| C. | 燃料有足够的空气就能充分燃烧 | |
| D. | 化学反应一定伴随着能量变化 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
A.反应为吸热反应;
B.酸碱中和反应为放热反应;
C.燃烧需要引发条件;
D.化学反应的实质是旧化学键断裂,新的化学键形成,过程中一定伴随能量变化;
解答 解:A.焦炭在高温下与水蒸气的反应属于吸热反应,故A正确;
B.氢氧化钾与硝酸的反应属于酸碱中和反应是放热反应,故B正确;
C.燃料有足够的空气和引发条件就能充分燃烧,如氢气和空气混合不点燃或光照不发生反应,故C错误;
D.化学反应的实质是旧化学键断裂吸收能量,新的化学键形成方程能量,反应过程中一定伴随能量变化,故D正确;
故选C.
点评 本题考查了化学反应实质、能量变化、反应条件等知识,注意知识的积累,题目难度不大.

练习册系列答案
相关题目
6.下列变化属于吸热反应的是( )
| A. | 氯酸钾分解制氧气 | B. | 生石灰与水反应生成熟石灰 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 液态水汽化 |
13.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
实验中以v(CO2) 表示的反应速率为,达平衡时CO 的体积分数为40%.
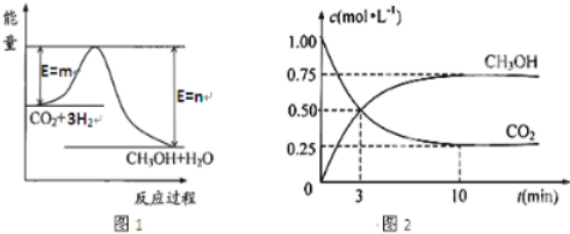
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变
b.1mol H-H 键断裂的同时断裂2mol H-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |
| 2 | 4 | 1.6 | 2.4 | 5 |
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下,在体积为1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
10.下列事实与胶体性质无关的是( )
| A. | 长江三角洲的形成 | |
| B. | 雾天容易看到车灯形成的光柱 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 向氢氧化铁胶体中加入硫酸溶液先出现浑浊后变澄清 |

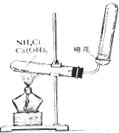 如图是实验室制取氨气的装置图,请回答下列问题:
如图是实验室制取氨气的装置图,请回答下列问题: