题目内容
下列叙述正确的是( )
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B、向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明AgCl的溶解度小于AgI的溶解度 |
| C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 |
| D、0.2 mol/L的NaHCO3溶液中c(H-)+c(Na+)=c(CO32-)+c(OH-)+c(HCO3-) |
考点:离子浓度大小的比较,pH的简单计算,酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.(NH4)2Fe(SO4)2溶液中亚铁离子抑制铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,溶质浓度越大;溶质中含有铵根离子数目越少,其浓度越大;
B.溶解度越小,难溶物越难溶,应该是氯化银的溶解度大于碘化银;
C.0.2 mol/L HCl溶液中氢离子浓度为0.2mol/L,0.05 mol/L Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合后氢离子过量,计算出混合液中氢离子浓度,然后判断溶液pH;
D.碳酸氢钠溶液中的电荷守恒判断.
B.溶解度越小,难溶物越难溶,应该是氯化银的溶解度大于碘化银;
C.0.2 mol/L HCl溶液中氢离子浓度为0.2mol/L,0.05 mol/L Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合后氢离子过量,计算出混合液中氢离子浓度,然后判断溶液pH;
D.碳酸氢钠溶液中的电荷守恒判断.
解答:
解:A.(NH4)2Fe(SO4)2溶液中亚铁离子抑制铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,NH4+浓度相等的(NH4)2SO4、NH4Fe(SO4)2的溶液中溶质浓度大小顺序为:(NH4)2SO4>NH4Fe(SO4)2,由于氯化铵中只含有1个铵根离子,则氯化铵的浓度最大,即:铵根离子浓度相等时,c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A正确;
B.向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明碘化银更难溶,则AgCl的溶解度大于AgI的溶解度,故B错误;
C.0.2 mol/L HCl溶液中氢离子浓度为0.2mol/L,0.05 mol/L Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合后氢离子过量,混合液中氢离子浓度为:
=0.05mol/L,溶液的pH≠1,故C错误;
D.0.2mol/L的NaHCO3溶液中,根据电荷守恒可得:c(H-)+c(Na+)=2c(CO32-)+c(OH-)+c(HCO3-),故D错误;
故选A.
B.向AgCl悬浊液中滴入KI溶液有AgI沉淀生成,说明碘化银更难溶,则AgCl的溶解度大于AgI的溶解度,故B错误;
C.0.2 mol/L HCl溶液中氢离子浓度为0.2mol/L,0.05 mol/L Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合后氢离子过量,混合液中氢离子浓度为:
| 0.2mol/L-0.1mol/L |
| 2 |
D.0.2mol/L的NaHCO3溶液中,根据电荷守恒可得:c(H-)+c(Na+)=2c(CO32-)+c(OH-)+c(HCO3-),故D错误;
故选A.
点评:本题考查了离子浓度大小比较、酸碱混合的定性判断及pH的计算,题目难度中等,明确盐的水解原理及其影响为解答关键,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力,C为易错点,注意混合液体积为原先的2倍.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列物质与其用途完全符合的有( )
①Al(OH)3-抗酸药 ②Si-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤NaClO-消毒剂 ⑥Al 和Fe2O3-焊接钢轨
⑦Fe2O3-红色油漆或涂料 ⑧MgO-耐火材料.
①Al(OH)3-抗酸药 ②Si-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤NaClO-消毒剂 ⑥Al 和Fe2O3-焊接钢轨
⑦Fe2O3-红色油漆或涂料 ⑧MgO-耐火材料.
| A、5条 | B、6条 | C、7条 | D、8条 |
下列说法不正确的是( )
| A、有色玻璃就是由某些胶态金属氧化物分散于玻璃中制成的 |
| B、放射性同位素可用于医疗用品消毒、药物作用机理研究和生物医学研究 |
| C、二氧化氯可用于环保、灭藻、漂白、保鲜、除臭等 |
| D、人体中极少量的NO会促进血管收缩,防止血管扩张 |
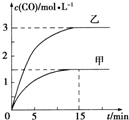 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
在相同条件下,下列气态氢化物的稳定性排列顺序正确的是( )
| A、HF>HCl>HBr>HI |
| B、HCl>HBr>HI>HF |
| C、HBr>HI>HF>HCl |
| D、HI>HBr>HCl>HF |
 +H2O(R、R1表示炔基或氢)
+H2O(R、R1表示炔基或氢)


 现有常温下的六份溶液:
现有常温下的六份溶液: