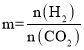题目内容
【题目】标准状况下,在盛有乙炔气体的密闭容器中通入一定量的Cl2,充分反应后,在光照条件下使生成的产物再与剩余的Cl2反应,最后得到三种物质的量分别为0.5 mol的多卤代烃,一共通入_____mol Cl2,将生成的HCl溶于水制100 mL溶液,则盐酸浓度为_____ mol·L-1。
【答案】4.5 15
【解析】
乙炔与氯气发生加成反应时,1mol乙炔能与2mol氯气发生加成反应生成CHCl2CHCl2;氯气与烷基在光照的条件下发生取代反应时,1mol氯气取代1molH,同时生成1molHCl,据此分析解答;根据HCl的物质的量与体积结合公式c=![]() 计算所配制的盐酸的浓度。
计算所配制的盐酸的浓度。
乙炔与氯气发生加成反应时,1mol乙炔能与2mol氯气发生加成反应生成CHCl2CHCl2;CHCl2CHCl2与Cl2光照下发生取代反应,得到三种物质的量都为0.5mol的多卤代烃,三种多卤代烃分别为CHCl2CHCl2,CHCl2CCl3,CCl3CCl3,根据C守恒,乙炔物质的量为1.5mol
CH≡CH+2Cl2→CHCl2CHCl2
1 2 1
1.5mol 3mol 1.5mol
CHCl2CHCl2+Cl2![]() CHCl2CCl3+HCl
CHCl2CCl3+HCl
1 1 1 1
0.5mol 0.5mol 0.5mol 0.5mol
CHCl2CHCl2+2Cl2![]() CCl3CCl3+2HCl
CCl3CCl3+2HCl
1 2 1 2
0.5mol 1mol 0.5mol 1mol
根据上述计算共需要氯气=3mol+0.5mol+1mol=4.5mol;答案为4.5mol;
反应生成的HCl物质的量为0.5mol+1mol=1.5mol,因此配制成100mLHCl溶液的浓度c=![]() =
=![]() =15mol/L,答案为15mol/L。
=15mol/L,答案为15mol/L。

【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)