题目内容
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.400℃,催化剂作用下,反应A:4HCl+O2═2Cl2+2H2O
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.400℃,催化剂作用下,反应A:4HCl+O2═2Cl2+2H2O(1)已知:
Ⅰ反应A中,4mol HCl被氧化,放出115.6kJ的热量.
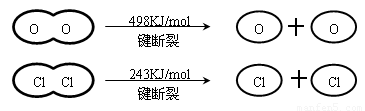
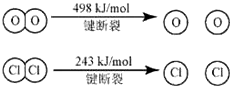
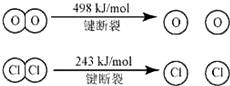
Ⅱ如图,①H2O的电子式是


②反应A的热化学方程式是
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
.③断开1mol H-O 键与断开 1mol H-Cl 键所需能量相差约为
32
32
KJ,H2O中H-O 键比HCl中H-Cl键(填“强”或“弱”)强
强
.分析:II①水是共价化合物依据电子式书写方法写出电子式;
②反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
③依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
②反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
③依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
解答:解:II①水是共价化合物,氧原子和两个氢原子形成两个共价键,电子式为: ,
,
故答案为: ;
;
②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
③焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强.
 ,
,故答案为:
 ;
;②依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
③焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,
4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6
E(H-O)-E(H-Cl)=31.9≈32,H2O中H-O键比HCl中H-Cl键强,
故答案为:32;强.
点评:本题考查了电子式的书写、热化学方程式书写,化学键键能和焓变关系计算,图象分析判断,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目

 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
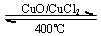 2Cl2+2H2O
2Cl2+2H2O