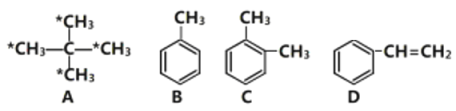
题目内容
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.用海水为原料,经一系列过程制得氧化镁固体,H2还原得镁
B.从海水中可以得到NaCl,电解熔融NaCl可制备Na
C.海水蒸发制海盐的过程中只发生了化学变化
D.目前工业上直接由海水提取I2
【答案】B
【解析】
A. H2很难将氧化镁还原为镁,通常采用电解熔融氯化镁的方法制镁,A错误;
B. 蒸发海水制得NaCl,电解熔融NaCl可制备Na,B正确;
C. 海水蒸发制海盐的过程中采用蒸发结晶的方法,不发生化学变化,C错误;
D. 目前工业上采用海带富集碘,再从海带中提取I2,D错误。
故选B。

【题目】1915年诺贝尔物理学奖授予Henry Bragg 和 Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol1) | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是______,Na核外有__________种不同的能级。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可用右图简单表示,其中配位键和氢键均采用虚线表示。

①SO42 中S的杂化类型是____________,与其互为等电子体的离子有___________(任写两种)
②已知 [Cu(NH3)4]2+ 具有对称的空间构型,[Cu(NH3)4]2+ 中的两个NH3被 Cl 取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______________。
③写出基态Cu2+ 的价层电子排布式:_________;金属铜采取_________堆积方式,已知Cu原子的半径为 r pm,NA 表示阿伏加德罗常数的值,金属铜的密度是_______________g/cm3(列出计算式)